作者:企鹅
太长不看版:HSP90是一种必需的伴侣蛋白,可以保护蛋白质组的完整性,在细胞蛋白质中占2%。最新一项发表在Molecular Cell杂志上的报道发现HSP90还具有通过进化保守的两亲性螺旋直接与膜相互作用并使膜变形的能力。使用新的无细胞系统和体内测量发现这种两亲性螺旋通过促进多泡体(MVB)与质膜的融合介导外泌体释放。该研究在结构上将HSP90膜变形功能与其分子伴侣活性分开,并且揭示了这种先前未发现的功能是外泌体释放所需的。
最新的一项研究报道了HSP90的新功能。HSP90是人体中最常见和研究最多的蛋白质之一。该研究对新药的开发具有重要意义。
比利时和澳大利亚的研究团队的最新研究表明,除了众所周知的蛋白质伴侣作用外,热休克蛋白HSP90还能刺激外泌体的释放。这项研究结果近日发表在学术期刊Molecular Cell上,为癌症和神经退行性疾病的治疗策略提供了新的视角。
HSP90是热休克蛋白90的缩写,是最常见的蛋白质之一,我们细胞中每100个蛋白质中就有1-2个。热休克蛋白在动物、植物甚至真菌中都是保守的。它们的名字可以追溯到20世纪80年代,当时它们被描述为一组在突然的热应激下上调的蛋白质。
“在过去的几十年里,我们学到了很多关于HSP90功能的知识,”通讯作者Patrik Verstreken教授说。
“作为蛋白质伴侣,它有助于正确折叠其他蛋白质,并在细胞应激的情况下稳定它们。HSP90还有助于降解无法挽救的受损或错误折叠的蛋白质。这些功能使HSP90成为细胞内蛋白质稳态的重要调节因子。”
这篇文章的研究表明,除了伴侣功能外,HSP90还有助于外泌体的释放。外泌体是含有囊泡的胞内体与细胞膜融合后从细胞释放的囊泡。它们可能含有信号分子,但也含有潜在的毒性蛋白。
根据Verstreken教授的说法,这些发现对许多神经退行性疾病都有影响。
“外泌体对于跨细胞的信号转导非常重要,但这些囊泡常常被有毒蛋白质如朊病毒、α-突触核蛋白或tau劫持,从而导致疾病在整个大脑中传播,”他说。
朊病毒是导致可传播的脑部疾病的有毒蛋白质,例如Creutzfeld-Jakob(有时被称为疯牛病);α-突触核蛋白或tau聚集体与帕金森病和阿尔茨海默病相关。 因此,更好地了解外泌体释放的机制可以为这些领域的药物开发提供信息。
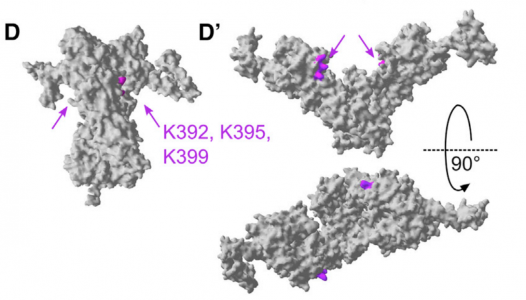
来自新南威尔士大学科学学院的Shelli R McAlpine副教授是该研究的共同作者,他说:“我们在新南威尔士大学实验室开发的分子与HSP90结合并将其锁定在一个封闭的构象中。该报告显示,这些分子通过将HSP90捕获在闭合构象中阻止膜融合,并阻止外泌体将其内容物释放到细胞外。
“通过将外泌体内容物保留在细胞内,我们的分子确保有毒物质不会扩散到周围环境中,从而可能保护生物体免受疾病传播。”
作为伴侣蛋白作用的一部分,已知HSP90稳定几种影响肿瘤生长的蛋白质。这就是为什么目前正在研究HSP90抑制剂用于癌症治疗的原因。Verstreken的研究小组发现,其中一些抑制剂也可能阻断外泌体的释放。
“我们发现一些正在开发用于临床用途的HSP90抑制剂,特别是那些在新南威尔士大学开发的抑制剂,实际上也抑制了外泌体释放,”Verstreken说。
“因此,我们的工作可能会为这些药物的作用方式带来重要的见解。”
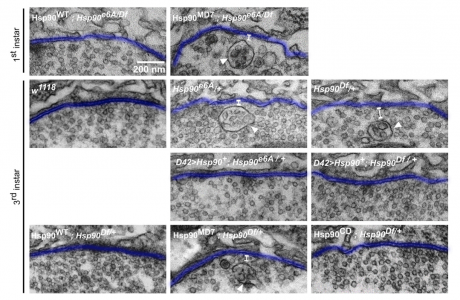
HSP90突变体导致质膜上多泡体积累
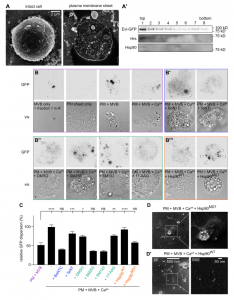
有活性的HSP90在无细胞实验中促进MVB与质膜融合
参考资料:infosurhoy
参考文献:Elsa Lauwers et al. Hsp90 Mediates Membrane Deformation and Exosome Release, Molecular Cell (2018). DOI: 10.1016/j.molcel.2018.07.016 IF= 14.248