作者:企鹅
大量研究证据表明,表面蛋白在免疫细胞之间转移的现象很普遍。具有不同于酶促切割或外泌体介导转移的特征,这种细胞表面蛋白质转移被不同的研究者称为“吸收(absorption)”、“内化(internalization)”或“trogocytosis(后文暂译为‘啃噬’)”(来自希腊语“trogo”,意思是啃或蚕食)。通常,细胞啃噬作用的过程是抗原依赖性的,其中一个最著名的例子是肽-主要组织相容性复合物(MHC)从抗原呈递细胞(APC)转移到T细胞。研究还发现了双向细胞啃噬作用,其中小鼠APC获得T细胞受体(TCR),并且对应的T细胞获得肽结合的MHC;然而,细胞吞噬过程的分子机制仍不清楚。已提出的机制包括两个突触膜的内吞作用或封闭的膜作为细胞的一部分被“撕掉”。
已经证明的细胞啃噬作用来自质膜的“直接囊泡出芽”,所得到的囊泡称为微粒、脱落囊泡、ectosomes或含有arrestin蛋白结构域的蛋白-1(Arrdc1)介导的微泡。与细胞啃噬作用不同,直接囊泡出芽需要酶,包括ATP酶液泡蛋白分选相关蛋白4(Vps4)和转运-1组分肿瘤易感基因101(TSG101)所需的内体分选复合物。Arrdc1定位于质膜,通过与Vps4和TSG101共同作用直接从质膜介导微泡出芽。与该发现一致,最近的报告证明TSG101将TCR分选到免疫突触(IS)中心,然后Vps4介导富含TCR的微泡出芽。然而,该报道尚不清楚微泡出现的质膜中的确切位置。
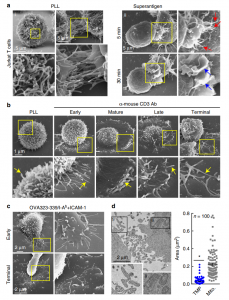
淋巴细胞含有丰富的柔性突起,称为微绒毛,其内部含有许多平行的肌动蛋白丝束,以手指的形式延伸细胞膜。以前的报道通过在微绒毛顶端分离两种淋巴细胞受体,L-选择蛋白和α4β7整合素,证明微绒毛在侵出的初始滚动阶段发挥作用,这对淋巴细胞在生理流动中的附着和滚动至关重要。至今,微绒毛的生物学作用仍未被研究透彻。然而,最近的超分辨率显微镜方法证明TCR高度聚集在微绒毛的尖端上,这表明这些表面呈现作为APC或靶细胞上抗原的有效传感器。此后不久,有报道描述了T细胞上微绒毛如何在抗原识别之前和期间搜索相对细胞和表面的机制。然而,除了它们在APC上的抗原感应中的关键作用之外,它们在T细胞活化期间是否起到必需功能的作用仍然很不清楚。
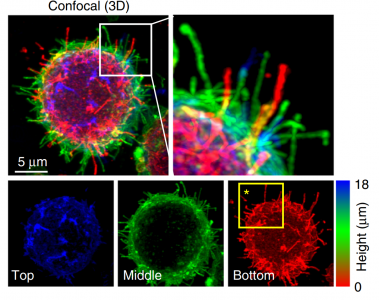
最新发表在Nature Communications上的这项研究观察到单个T细胞与APC的接触通过微绒毛延伸发生,其似乎用作隔离免疫重要分子的位置,包括TCR复合物、共刺激分子和粘附分子以及各种细胞因子。研究发现微绒毛通过两种独立机制(细胞啃噬作用和膜出芽)的联合作用与T细胞体分离,并沉积在同源APC的表面,从而可能作为向同源APC递送T细胞信息的有效手段。与这种潜在作用一致,这些T细胞微绒毛衍生颗粒(TMP)能够独立地激活同源树突细胞(DC)。因此,该研究结果表明T细胞微绒毛可能作为“免疫突触体”与TMPs作为一类膜囊泡充当T细胞信息的传递者或同源APC的特征。
论文摘要:
已有报道提出T细胞上的微绒毛参与到抗原呈递细胞(APC)的表面或促进流动下的粘附;然而,它们是否在T细胞活化期间发挥功能仍不清楚。该研究显示抗原特异性T细胞将来自微绒毛的膜颗粒沉积到携带同源抗原的APC的表面上。微绒毛在T细胞活化的所有阶段携带T细胞受体(TCR),并在细胞啃噬(trogocytosis)过程中作为大的富含TCR的T细胞微绒毛颗粒(TMP)释放。这些微绒毛仅含有arrestin蛋白结构域的蛋白质1,其直接参与膜出芽,并且与液泡蛋白质分选相关蛋白质4组合,将大的TMP转化为较小的外泌体大小的TMP。值得注意的是,来自CD4+ T细胞的TMP富含LFA-2/CD2和参与激活树突细胞的各种细胞因子。总之,这些结果证明T细胞微绒毛构成携带T细胞信息至APC的“免疫突触体”。
T细胞在TCR刺激后产生微绒毛来源的颗粒
T细胞的共聚焦显微镜成像(z-position进行颜色编码)
参考文献:
Kim HR, Mun Y, Lee KS, Park YJ, Park JS, Park JH, Jeon BN, Kim CH, Jun Y, Hyun YM, Kim M, Lee SM, Park CS, Im SH, Jun CD. T cell microvilli constitute immunological synaptosomes that carry messages to antigen-presenting cells. Nat Commun. 2018 Sep 7;9(1):3630. doi: 10.1038/s41467-018-06090-8.