骨髓来源的间充质干细胞(BM-MSC)能够迁移至肿瘤并参与肿瘤微环境调控的祖细胞。 BM-MSCs通过释放细胞因子或外泌体在肿瘤发展过程中发挥重要作用。然而,BM-MSCs如何影响结肠癌细胞中肿瘤干细胞的干性仍然知之甚少。近日,来自中国医科大学的研究人员在Br J Cancer杂志中发表文章,证明BM-MSC衍生的外泌体促进结肠癌中的肿瘤干细胞的产生,并且外泌体miR-142-3p在该过程中起重要作用。
结肠癌是全球癌症相关死亡的三大主要原因之一,尽管已开发出许多针对结肠癌的靶向药物,但手术切、化疗、放射治疗仍然是标准治疗方法。此外,结肠癌患者经常在原发性肿瘤的综合治疗后发生转移或复发。肿瘤细胞转移时患者无显著症状,因为播散的细胞似乎处于休眠状态且无法检测到。休眠的肿瘤细胞主要是属于肿瘤干细胞。结肠癌干细胞(CSC)的存在被认为对化学、放射疗法具有抗性并且是复发的主要原因。然而,由于CSC与正常干细胞相似,因此开发针对休眠CSC的治疗是艰巨的。因此,靶向CSC的领域的下一个重大进展是找到更深层的发生机制,即寻找结肠癌肿瘤微环境中的促CSC表型和机制。
与其他肿瘤一样,结肠癌肿瘤微环境包含影响肿瘤的许多因子和细胞类型,例如免疫细胞、基质细胞和内皮细胞。如今,有大量证据表明骨髓间充质干细胞(BM-MSCs)也可以迁移到原发肿瘤并参与肿瘤微环境,促进肿瘤基质形成并影响肿瘤细胞活性。 BM-MSC与肿瘤细胞之间的相互作用可通过多种方式发生。 BM-MSCs可在肿瘤环境中分泌多种细胞因子。 MSCs还可通过与邻近肿瘤细胞的物理接触通过细胞间信号传导直接作用,并最终决定肿瘤的命运。除此之外,一些研究表明MSCs需要外泌体依赖的特殊递送系统。外泌体是内吞起源的小(50-100nm)囊泡,很多细胞类型在细胞外环境中会释放外泌体。最近报道,外泌体还含有信使RNA(mRNA)和microRNA,然后转移到靶癌细胞,在靶细胞参与翻译抑制或RNA沉默。总之,BM-MSCs在许多肿瘤过程中起着至关重要的作用。然而,BM-MSC衍生的外泌体如何影响肿瘤干细胞尚不清楚。
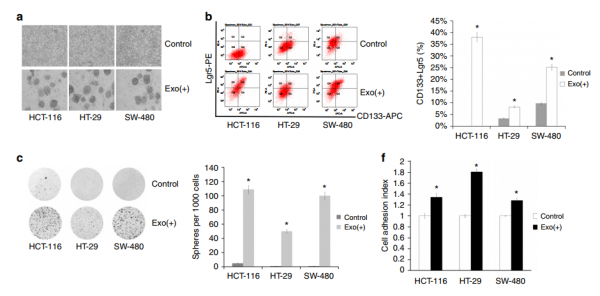
研究人员从BM-MSC分离外泌体并使用这些外泌体来处理结肠癌细胞(HCT-116,HT-29和SW-480)。通过细胞表面标记(CD133和Lgr5)和功能测定比较结肠癌CSC的干性,例如化学抗性、集落形成、细胞粘附、侵袭和肿瘤形成。研究人员进行了microRNA阵列研究结肠癌细胞、BM-MSCs和共培养细胞之间的外泌体microRNA表达的差异,并进行了基因靶标的功能和分子分析。结果发现,BM-MSC衍生的外泌体含有不同的microRNA,包括miR-142-3p,能够增加结肠癌细胞群体中的CSC的数量。从BM-MSC衍生的外泌体中降低miR-142-3p表达能够明显降低结肠癌CSC的群体。在机制上发现Numb是miR-142-3p的靶基因,并且miR-142-3p通过下调Numb促进Notch信号传导途径。结果表明,BM-MSC衍生的外泌体通过miR-142-3p促进结肠癌干细胞样特性。
图:BM-MSC衍生的外泌体促进结肠癌细胞的干细胞样特性
参考文献:Li H, Li F. Exosomes from BM-MSCs increase the population of CSCs via transfer of miR-142-3p. Br J Cancer. 2018 Sep 17.