作者:企鹅
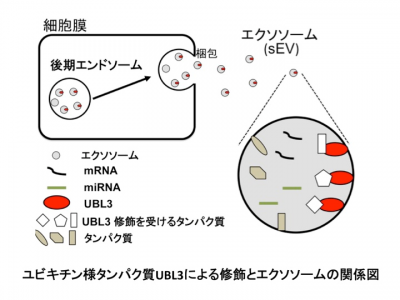
sEVs是从各种细胞类型分泌的纳米级囊泡。外泌体,一种源自多泡体(MVB)的sEV,通过转运蛋白质、mRNA和miRNA介导细胞间通讯。sEV(包括外泌体)在细胞之间递送蛋白质与肿瘤进展和神经退行性疾病有关。此外,神经退行性疾病相关蛋白如β淀粉样蛋白、tau、α-synuclein和朊病毒也可包装在sEVs内,并在脑中传播。这些结果表明,通过sEVs运输细胞内蛋白质参与了各种类型疾病的发生发展。然而,蛋白质分选进sEVs的分子机制尚不完全清楚。
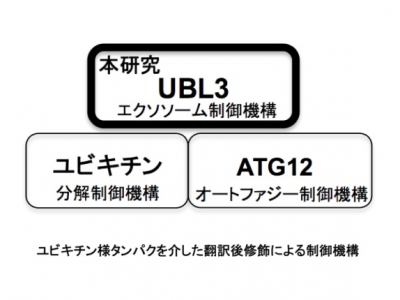
蛋白质在被合成后,经历各种翻译后修饰(PTM),这些修饰影响多种细胞过程。泛素依赖性修饰系统是细胞内的蛋白质降解系统之一,参与多种细胞过程。以前的研究发现突触蛋白Ves1-1S的水平和定位由泛素蛋白-蛋白酶体系统控制。此外,使用生物信息学分析,将SCRAPPER蛋白鉴定为突触E3泛素连接酶。据报道,一些蛋白质具有泛素蛋白样序列,称为“UBL结构域”。一些UBLs可参与翻译后修饰;包括小泛素样修饰物(SUMO)和Nedd8。另一方面,作为保守的UBL之一,UBL3/MUB蛋白已在拟南芥中鉴定,并且是通过异戊烯化定位的膜蛋白。然而,UBL3/MUB作为PTM因子的作用仍然知之甚少。
图片来源:藤田保健卫生大学
来自日本的研究人员最新在Nature Communications杂志上发表文章,报道了UBL3/MUB充当PTM因子,调节蛋白质分选至sEVs。
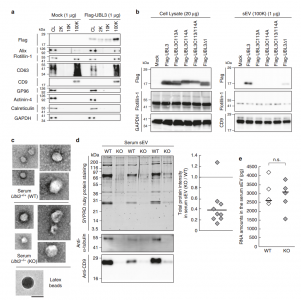
该研究发现UBL3修饰对于将UBL3分选到MVB和sEVs是必不可少的。还观察到,与野生型小鼠相比,从Ub13敲除小鼠中纯化的sEVs中总蛋白水平降低了60%。 通过蛋白质组学分析,发现了1241种与UBL3相互作用蛋白,包括Ras。UBL3直接修饰Ras和致癌RasG12V突变体,并且UBL3表达通过UBL3修饰增强RasG12V分选到sEVs。总的来说,这些结果表明UBL3的PTM影响sEVs的蛋白质分选。
在Ub13敲除小鼠中,血清sEVs中的总蛋白水平降低
该研究数据表明UBL3通过其C末端的半胱氨酸残基二硫键修饰靶蛋白;因此,尽管UBL3具有泛素蛋白样结构域,但UBL3修饰与常规泛素和泛素蛋白样修饰完全不同。根据UBL3Δ1突变体的结果,单独UBL3的膜定位不足以进行UBL3修饰。因此,除了用于UBL3的C末端中膜定位的CAAX基序之外,可能存在C末端区域中UBL3修饰的其它重要氨基酸序列。在以后的UBL3研究中,需要分析识别用于UBL3修饰的C末端序列的分子。
该结果表明UBL3可能参与超过所有外泌体蛋白一半的分选。UBL3与特定蛋白质的结合可能是瞬时的,从而使得在细胞裂解物的综合蛋白质组学分析中仅鉴定到UBL3修饰的蛋白质的一部分。或者,可能仅有限数目的参与大蛋白质-蛋白质相互作用网络的靶蛋白需要UBL3修饰以靶向外泌体;但是,这一想法必须通过进一步探究证实。
UBL3修饰的抑制也可能是sEVs相关疾病的治疗靶点。该结果还表明,通过UBL3标记可将外源蛋白质分选进sEVs。因此,对于任何其他类型的sEVs相关疾病,UBL3可以作为修饰工具产生装载治疗性物质的sEVs。
参考文献:
Ageta, H., et al. (2018). "UBL3 modification influences protein sorting to small extracellular vesicles." Nat Commun 9(1): 3936.
外泌体资讯网 Nature子刊:UBL3修饰影响外泌体蛋白的分选