作者:红薯
外泌体是大部分细胞都可以分泌的具有双层膜结构的囊泡。这给了它独特的生物学和药理学方面潜力。最近南加州大学的张勇教授课题组,设计了一种合成多抗体靶向的外泌体 (synthetic multivalent antibodies retargeted exosomes/SMART-Exos),将T细胞特异表达的膜表面蛋白CD3的抗体和三阴性乳腺癌细胞特异表达的膜蛋白的EGFR抗体表达到外泌体上,SMART-Exos除了能够特意的将T细胞和乳腺癌细胞拉到一起,也能在体外和体内诱发强烈的免疫反应。这种理念和设计,将为肿瘤免疫治疗提供一种新的无细胞疗法。本文发表在JACS(IF= 14.357)。
在不同种类的人体体液中几乎都能够找到外泌体,它们在细胞间交流过程中发挥着重要作用。外泌体膜结构上的CD9分子提高了其与细胞融合的效率,能够有效提高其治疗价值。CD47在外泌体膜结构上的作用是防止外泌体被单核细胞和巨噬细胞所消化。更重要的是,相比于病毒来源以及合成的纳米载体,外泌体具有更低的免疫原性。这种独特的药理学效应,使得外泌体具有独特的纳米药用价值。
已有很多文献报道外泌体作为治疗剂载体在治疗人类的多种疾病方面都具有极高的应用潜力和价值。目前的研究证实有多种类型细胞来源的外泌体能够用于治疗。目前研究人员已经尝试并开发了多种物理化学方法将外源的干扰RNA和化学药物包装到外泌体中。这些广泛的应用引导出一个新的问题,能否将外泌体改造成一个可以控制免疫反应的免疫控制器,来引导和调节免疫细胞的免疫反应活性。这样可能开发出外泌体用于治疗的全新策略。
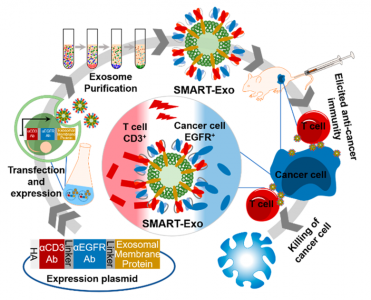
表达CD3和EGFR抗体的外泌体(SMART-Exos)合成原理图,以及调节T细胞免疫反应原理图
如上图,张勇教授课题组,将CD34和EGFR抗体表达在外泌体(SMART-Exos)上,SMART-Exos能够特异性的引导T细胞到三阴性的乳腺癌细胞周围,从而诱导免疫反应。在体外实验中,在有人体外周血单核细胞存在的培养皿(PMBCs)上,SMART-Exos能够大量杀伤EGFR阳性的三阴性乳腺癌细胞。在体内实验中,将移植异种癌细胞的老鼠模型,注射SMART-Exos后,具有非常明显的抗癌效果。
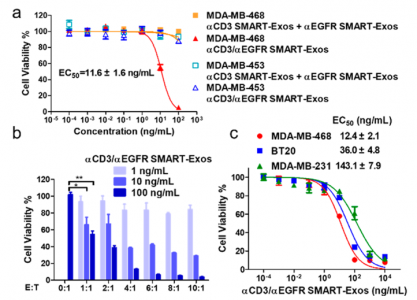
SMART-Exos的体外细胞毒性实验
上图为SMART-Exos在体外实验中的结果图。如上图a,体外实验中,在PBMCs上,EGFR阳性的MDA-MB-468细胞系与CD3抗体/EGFR抗体双阳的SMART-Exos联合培养,具有最低的EC50值。如上图b,可以看到当以100ng/ml的浓度和外泌体:癌细胞>4的时候,毒杀细胞的效果已经非常明显。如上图c,可以看到EGFR阳性率最高的MDA-MB-231,具有最低的EC50值,说明SMART-Exos的作用效果与靶细胞抗原蛋白阳性率有关。
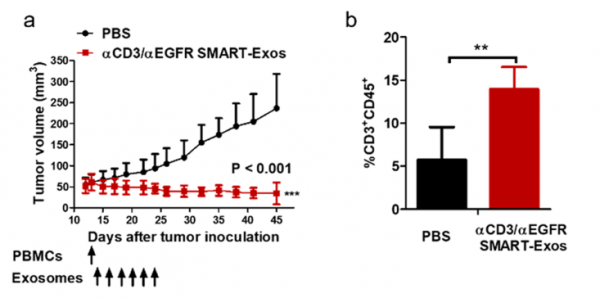
SMART-Exos在体内实验的结果图
上图为SMART-Exos在体内实验的结果图。如图a,可以看到加入SMART-Exos后,小鼠体内的肿瘤体积明显小于加PBS的组。同时,从b可以看出,加入SMART-Exos的组,癌细胞周围T细胞免疫浸润程度明显高于对照组。
本文创造性地在外泌体上表达免疫细胞特异性表面蛋白CD3抗体和三阴性乳腺癌细胞表面蛋白EFGR抗体,从而达到了调节免疫活性的效果。为外泌体地应用扩宽了外延。该技术的发展对于提高肿瘤免疫疗法的响应性和响应程度具有十分重要的意义。
参考文献:
Cheng Q1, Shi X1, Han M1, Smbatyan G2, Lenz HJ2, Zhang Y1,3,4,5. Reprogramming Exosomes as Nanoscale Controllers of Cellular Immunity. J Am Chem Soc. 2018 Nov 19. doi: 10.1021/jacs.8b10047