橙子
目前鞘磷脂酶抑制剂GW4869基本上是本领域公认的外泌体抑制剂,被认为可以抑制外泌体的分泌。在外泌体的功能研究中,设计抑制外泌体分泌的对照实验是自然而然的一件事情,许多人都会首选GW4869。然而,GW4869抑制外泌体分泌的原理是什么?我们真的可以贸然使用GW4869吗?它对所有细胞都有抑制效果吗?对于某些我们研究的特定蛋白(或外泌体亚型、核酸、脂质等),它也有抑制效果吗?这些问题都需要大家在设计实验的时候仔细思考。
下面,我希望能通过介绍几篇文献的方式,让大家对GW4869的发现、原理、已验证起作用的细胞以及外泌体内容物有初步的了解。
- GW4869的发现
首次认为GW4869可以抑制细胞分泌外泌体的文献来自德国哥根廷大学的Mikael Simons教授,发表于2008年的Science1。这位教授的研究领域包含蛋白与脂质的运输,因此他当时提出疑问:在细胞发生内吞以后,蛋白和脂质有两种命运——multivesticular endosomes (MVEs)传递intraluminal vesicles (ILVs)到溶酶体中降解;或MVEs与细胞膜融合,释放ILVs到胞外,成为外泌体的货物,这些蛋白和脂质是如何被分选到不同的亚型中呢?
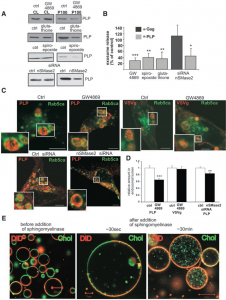
为了研究这个问题,他选择了一种膜蛋白proteolipid protein (PLP),细胞为Oli-neu cell,一种鼠源少突胶质细胞,在他们之前的研究中已经证明该细胞含有很多MVEs。首先证明PLP在外泌体中存在,接下来证明PLP是通过核内体途径到达外泌体的,Rab5Q79L突变破坏掉核内体运输,电镜观察发现核内体变大,里面充满ILVs,而且western显示PLP在外泌体中减少。接着研究核内体上的膜蛋白是如何隔离开外泌体成分和非外泌体成分的,核内体的降解途径之前已经有所研究,在早期核内体膜的网格蛋白覆盖的微区包含泛素结合蛋白Hrs,可以分选泛素化蛋白到该区域进入降解途径,然而PLP并不与Hrs共定位,而是与flotillin——脂筏区的一种膜脚手架蛋白以及糖基化磷脂酰肌醇GPI共定位,这提示我们PLP被分选入外泌体中与脂筏区有关。然后该文章证明了PLP进入ILVs中与ESCRT机制无关,敲低Hrs、TSG101以及Alix之后,PLP的inward budding没有变化。
那么这种与ESCRT机制无关的budding机制是什么呢?质谱数据显示,外泌体上的脂质成分与脂筏区相似,富含胆固醇、鞘脂类、饱和卵磷脂以及神经酰胺。神经酰胺是鞘磷脂(SM)被鞘磷脂酶水解掉胆碱磷酸之后的产物,外源添加鞘磷脂酶抑制剂或C6-神经酰胺可导致囊泡的形成。因此为了研究神经酰胺在外泌体形成中的作用,用GW4869处理细胞后,超速离心成分中的PLP和CD63减少,在核内体腔中的PLP减少。最后,文章做了一个我认为最有说服力的实验,在体外合成了单层脂质体,有流动性强的非脂筏区(红)和有序的脂筏区(绿),在外源添加鞘磷脂酶后,从脂筏区开始向内出芽形成小囊泡。
小结一下,这篇文章证明了有一种ESCRT-independent、与脂筏区有关的外泌体分选途径,神经酰胺在其中起到了重要作用。对我们设计实验有什么参考价值呢?首先,如果你的研究对象是外泌体中的某种物质,你要确定该物质是与哪种机制有关的,GW4869是否可以抑制这种物质的分泌;其次,如果你研究的是外泌体分泌的数量变化,这篇文章并没有证明GW4869可以使外泌体数量减少;最后,这篇文章并没有证明该机制在不同细胞上的普适性,具体细胞还要具体分析。
二、GW4869的应用
从08年至今,有许多文献都采用了GW4869作为外泌体分泌的抑制剂,下表中我列举了我读到过的几篇用到的文献,它们使用的细胞、浓度以及使用GW4869的目的都有不同。
| 年份 | 细胞 | 浓度 | 研究内容 |
| 2015 | RAW264.7 巨噬细胞 | 10、20 um | GW4869抑制巨噬细胞通过外泌体释放促炎因子,有利于败血症中心功能障碍的治疗2 |
| 2010 | HEK293 | 10 um | GW4869抑制细胞分泌多种外泌体miRNAs3 |
| 2016 | MEF | 2.5 um | 带有WW-tag的蛋白可被Ndfip1识别,泛素化后载入外泌体中,GW4869可抑制其分泌4 |
| 2017 | L细胞 SKBR3细胞 | 5 um | GW4869抑制外泌体的分泌,促进EV的分泌5 |
| 2017 | 上皮细胞 间质细胞 | 10 um | GW4869抑制上皮间质细胞外泌体分泌(总蛋白的量),导致小鼠牙器官发育不全6 |
15年这篇关注点在促炎因子上面,因此它只测了加GW4869后,外泌体中TNF-α、IL-1β、IL-6等蛋白的变化,发现有抑制作用,后面用GW4869对小鼠内毒素引起的心功能障碍有治疗效果。
10年这篇关注点在外泌体miRNAs分泌机制上面,它不但测了GW4869对外泌体中内源性的miR-16和外源性的miR-146a有抑制作用,而且Alix knockdown之后外泌体miR-146a的量并没有变化,因此证明了miRNAs在外泌体中的分泌与神经酰胺有关,但与ESCRT无关。
16年这篇文章发现了一种将目的蛋白装载入外泌体中的方法,它选择了Cre重组酶,将目的蛋白——Cre重组酶加上一个WW-tag后,Ndfip1蛋白的L-domain可以识别这个tag,从而将目的蛋白泛素化后装载入外泌体的目的,而GW4869抑制了外泌体中WW-cre以及TSG101的量。
17年这篇发表在JEV上的文章是对GW4869作用的一个扩充,它发现GW4869不仅可以抑制外泌体的分泌,还可以增加EV(10000g沉淀组分)的分泌。
17年发表在ACS nano上的文章关注外泌体在细胞交流中的作用,因此用总蛋白的量验证GW4869可以抑制外泌体分泌后,直接做了功能实验。
以上几篇不同类型的文章涉及不同的细胞,用了不同的药物浓度,做了不同的研究实验。而我们在以后的研究过程中,如果要用到GW4869,需要注意的是:作用的细胞是哪种;GW4869是否可以抑制外泌体整体的分泌(NTA、总蛋白、总RNA的量);是否可以抑制外泌体中我们关注的分子的量(western、PCR);GW4869的浓度选择;如果关注点在分泌机制上,最好做一下ESCRT分泌途径的对照。
最后提一句,如果大家对自己的细胞用了各种浓度的GW4869,发现并没有抑制外泌体分泌的效果,可以试一下另一种外泌体抑制剂——DMA7,8,最近看文献发现的,比GW4869发现的更早,但是貌似没什么人知道,我还没有仔细研究,感兴趣的可以读一下参考文献7和8。
- Trajkovic K, Hsu C, Chiantia S, Rajendran L, Wenzel D, Wieland F, Schwille P, Brügger B, Simons M. Ceramide triggers budding of exosome vesicles into multivesicular endosomes. Science. 2008 Feb 29;319(5867):1244-7.
- Essandoh K, Yang L, Wang X, Huang W, Qin D, Hao J, Wang Y, Zingarelli B, Peng T, Fan GC. Blockade of exosome generation with GW4869 dampens the sepsis-induced inflammation and cardiac dysfunction. Biochim Biophys Acta. 2015 Nov;1852(11):2362-71.
- Kosaka N, Iguchi H, Yoshioka Y, Takeshita F, Matsuki Y, Ochiya T. Secretory Mechanisms and Intercellular Transfer of MicroRNAs in Living Cells.J Biol Chem. 2010 Jun 4;285(23):17442-52.
- Sterzenbach U, Putz U, Low LH, Silke J, Tan SS, Howitt J. Engineered Exosomes as Vehicles for Biologically Active Proteins. Mol Ther. 2017 Jun 7;25(6):1269-1278.
- Menck K, Sönmezer C, Worst TS, Schulz M, Dihazi GH, Streit F, Erdmann G, Kling S, Boutros M, Binder C, Gross JC. Neutral sphingomyelinases control extracellular vesicles budding from the plasma membrane. J Extracell Vesicles. 2017 Sep 26;6(1):1378056.
- Jiang N, Xiang L, He L, Yang G, Zheng J, Wang C, Zhang Y, Wang S, Zhou Y, Sheu TJ, Wu J, Chen K, Coelho PG, Tovar NM, Kim SH, Chen M, Zhou YH, Mao JJ. Exosomes Mediate Epithelium−Mesenchyme Crosstalk in Organ Development. ACS Nano. 2017 Aug 22;11(8):7736-7746.
- Savina A, Furlán M, Vidal M, Colombo MI. Exosome release is regulated by a calcium-dependent mechanism in K562 cells. J Biol Chem. 2003 May 30;278(22):20083-90.
- Miao Y1, Li G, Zhang X, Xu H, Abraham SN. A TRP Channel Senses Lysosome Neutralization by Pathogens to Trigger Their Expulsion. Cell. 2015 Jun 4;161(6):1306-19.
外泌体资讯网 浅谈外泌体抑制剂——鞘磷脂酶抑制剂GW4869