土豆
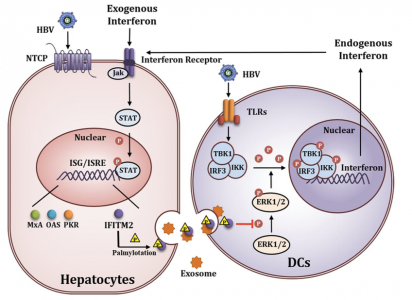
干扰素(IFN)信号传导途径中的负调节因子抑制肝内免疫应答,导致对慢性乙型肝炎(CHB)患者中IFN-α治疗的应答不佳。近日,来自四川大学华西医院唐红课题组研究人员在Hepatology杂志(IF 14.079)上发表文章发现,外泌体介导的IFITM2蛋白转运至树突状细胞可抑制IFN-α通路的激活,并阻断IFN-α的抗HBV功效。该研究为CHB患者对IFN-α治疗的应答不佳提供了新的解释。
全世界大约有2.4亿人被乙型肝炎病毒(HBV)感染。持续的HBV感染会导致慢性乙型肝炎(chronic hepatitis B,CHB)并增加终末期肝病包括肝硬化和肝细胞癌(HCC)的风险。目前,核苷酸类似物(NUC)和聚乙二醇化干扰素α(Peg-IFNα)是推荐的抗HBV药物。Peg-IFNα具有有限的治疗持续时间和实现功能性治愈的优点。然而,Peg-IFNα对CHB患者的治疗结果仍然不是最佳。研究报道,在进行48周Peg-IFNα治疗CHB的后24周,HBeAg阳性患者的持续病毒学应答率(HBV DNA <2000 IU / mL)仅为30%,而HBeAg阴性患者为43%。因此改善基于IFN-α治疗的反应性仍然是CHB患者治疗中的基本问题。
IFNα的抗病毒功效是通过复杂的免疫反应实现的。当宿主被病毒感染时,先天免疫是病原体的第一道防线。在宿主识别入侵的病毒抗原后,内源性IFNα通过激活MAPK依赖的TANK结合激酶1(TBK1)和干扰素调节因子3(IRF3)的磷酸化而被触发合成。内源性IFNα与IFNα受体(IFNAR)结合,激活下游途径,尤其是JAK-STAT途径。激活后,形成STAT的同二聚体或异二聚体并转移到细胞核中以与干扰素敏感的反应元件(ISRE)结合,启动干扰素刺激的基因(ISG)的转录。一些ISG编码抗病毒成分,如Mx1、PKR或OAS1能直接抑制病毒复制,而还有一些ISG编码蛋白质以发挥免疫调节功能,这些免疫调节性ISG催化各种免疫反应,例如病原体识别、免疫细胞活化和内源性IFN合成。有趣的是,一些ISG编码的蛋白质会对IFN系统产生负面影响,从而损害宿主免疫防御。因此,鉴定那些关键的负调节因子并阐明其机制对于提高IFNα的抗HBV功效至关重要。
外泌体,直径在30-150nm之间,是由几乎所有类型的细胞产生的脂质双层天然纳米颗粒。外泌体通过携带和运输功能性蛋白质、脂质和核酸,介导细胞间通讯而起到细胞间信使的作用。据报道,许多编码ISG的蛋白质被包装到外泌体中并穿梭到相应的受体细胞,从而触发下游信号传导。外泌体介导的ISG在IFN信号传导途径的调节中起重要作用。
在本研究中,从GEO数据库(GSE54747)中,研究人员下载并分析了对IFN-α具有不同反应的CHB患者的基因表达谱,并发现先天免疫状态与CHB患者中基于IFN-α的治疗反应相关。研究人员发现外泌体介导IFITM2向树突状细胞的转运抑制了IFN-α合成,导致外源性IFN-α处理下的IFN途径出现了应答障碍。IFITM2属于IFITM家族,具有保守的跨膜结构,是一种经典的ISG,据报道IFITM2抑制一些RNA病毒复制,同时促进一些DNA病毒的复制,这表明当宿主面对不同的病原体时,IFITM2可能发挥不同的作用。PCR array结果显示,IFN诱导的IFITM2 mRNA的基线水平较高,而IFN-α治疗的CHB患者PBMC中IFN-αmRNA水平较低。无应答患者的血清中也发现了IFITM2蛋白水平增加。此外,研究人员证明棕榈酰化抑制剂和IFITM2蛋白的70/71位点上的突变均影响其被外泌体摄取。该研究结果解释了CHB患者对IFN-α治疗的不良应答反应的发生机制。
参考文献:Shi Y, Du L, Lv D, Li H, Shang J, Lu J, Zhou L, Bai L, Tang H. Exosomal IFITM2 transmitted to DCs inhibits IFNα pathway activation and blocks anti-HBV efficacy of exogenous IFNα. Hepatology. 2019 Feb 5. doi: 10.1002/hep.30548.
外泌体资讯网 四川大学华西医院唐红课题组:外泌体IFITM2向树突状细胞的传递抑制IFNα途径活化并阻断外源IFNα的抗HBV功效