作者:企鹅
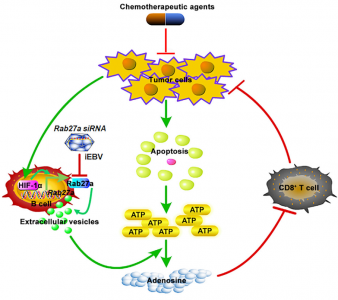
CD39+CD73+EV可以将ATP水解成腺苷以抑制T细胞活化。然而,从化学治疗的肿瘤细胞中大量释放ATP的结果仍不清楚。来自浙江大学医学院的蔡志坚教授、王建莉教授合作在最新的Immunity(影响因子19.734)发表文章,报道了B细胞衍生的CD39+CD73+ EVs将肿瘤细胞ATP水解成腺苷,从而抑制化疗后CD8+ T细胞反应。减少该EV的产生可增强化疗的效果。
化疗仍然是晚期癌症最经典的治疗方法之一。据报道,一些化学治疗剂会通过消除免疫抑制细胞或引发肿瘤细胞的“免疫原性细胞死亡”来增强抗肿瘤免疫力。然而,化疗长期以来一直与全身免疫抑制的诱导有关。许多化学治疗剂是骨髓抑制剂,可以抑制骨髓中血细胞的产生并减少绝对白细胞数量,引起淋巴细胞减少。因此,化疗后全身免疫抑制的改善是改善化疗后抗肿瘤免疫力所必需的。
众所周知,细胞外腺苷主要通过T细胞表面上的A2A腺苷受体(A2AR)发出信号来抑制T淋巴细胞活化和效应功能。CD39(ectonucleoside triphosphate diphosphohydrolase 1-Entpd1)将ATP和ADP水解为AMP。此后,CD73(ecto-5'-核苷酸酶-Nt5e)将AMP水解成腺苷。化学疗法诱导肿瘤细胞大量释放ATP,释放的ATP被CD39和CD73水解成腺苷,这会损害抗肿瘤T细胞反应。
细胞外囊泡(EV),包括ectosomes、oncosomes、脱落的微泡(microvesicles)和微粒(microparticles),可以调节免疫功能。来自调节性T细胞的CD73+ EV通过产生腺苷来增强其抑制活性。来自癌细胞的CD39+CD73+ EV促进细胞外腺苷的产生并负调节T细胞功能。然而,CD39+CD73+ EV是否能将ATP从化疗处理的肿瘤细胞水解成腺苷并影响抗肿瘤免疫仍不清楚。
来自浙江大学医学院的蔡志坚教授、王建莉教授合作发现来自B细胞的CD19+ EV含有高水平的CD39和CD73,其将化学疗法处理的肿瘤细胞释放的ATP水解成腺苷,并通过抑制CD8+ T细胞应答来减弱化疗效果。HIF-1α通过上调肿瘤宿主中的Rab27a表达来增强B细胞中的EV生成。通过灭活的Epstein-Barr病毒(iEBV)介导的siRNA(小干扰RNA)转移沉默Rab27a抑制B细胞中CD19+ EV的产生并大大改善化学治疗效果。因此,该研究结果阐明了化疗后T细胞反应的调节。
全身免疫抑制极大地影响了化学治疗的抗肿瘤作用。该研究显示来自B细胞的CD19+细胞外囊泡(EV)通过CD39和CD73囊泡掺入的蛋白质将化学治疗的肿瘤细胞中的ATP水解成腺苷,从而损害CD8+ T细胞应答。携带肿瘤的小鼠和患者的血清CD19+ EVs增加。血清CD19+ EV较少的患者化疗后预后较好。上调的HIF-1α通过诱导Rab27a mRNA转录促进B细胞释放CD19+ EV。B细胞中Rab27a或HIF-1α缺失抑制CD19+ EV的产生并改善化学治疗抗肿瘤作用。通过携带Rab27a siRNA的灭活的Epstein-Barr病毒沉默B细胞中的Rab27a极大地改善了人源化免疫受损的NOD Prkdcscid Il2rg-/-小鼠的化疗效果。因此,减少CD19+ EV具有改善化学治疗抗肿瘤效果的高潜力。
该研究在肿瘤患者中发现了更高水平的血清CD19+ EVs,即使是那些早期肿瘤患者也是如此。此外,血清CD19+ EVs较低的患者在化疗后具有较长的PFSPs,并且手术切除肿瘤大大降低了患者的血清CD19+ EVs。因此,异常高水平的血清CD19+ EVs的检测对于肿瘤患者的诊断、预后和治疗效果的评估可能是有价值的。总之,该研究结果揭示了肿瘤细胞在化疗后逃避免疫监视的机制,可能有助于抗肿瘤治疗的设计。
参考文献:
Fanghui Zhang, Rongrong Li, Yunshan Yang, Chunhui Shi, Yingying Shen, Chaojie Lu, Yinghu Chen, Wu Zhou, Aifu Lin, Lei Yu, Wanjing Zhang, Zhenwei Xue, Jianli Wang, Zhijian Cai. Decrease in B-Cell-Derived Extracellular Vesicles Enhances Post-Chemotherapeutic CD8+ T Cell Responses. Immunity. Published: February 12, 2019DOI:https://doi.org/10.1016/j.immuni.2019.01.010 影响因子19.734