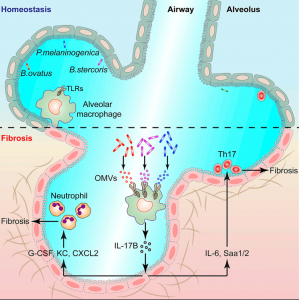
近日,国际学术期刊Immunity在线发表了中国科学院上海营养与健康研究所钱友存课题组的最新研究成果“Dysregulated Lung Commensal Bacteria Drive Interleukin-17B Production to Promote Pulmonary Fibrosis through Their Outer Membrane Vesicles”。在该项研究中,研究人员系统分析了肺纤维化病理组织中微生态菌群的变化,发现其中Bacteroides和Prevotella两种菌属明显升高,并可以通过分泌外膜囊泡(Outer membrane vesicles, OMVs)调控白介素-17B (IL-17B) 的产生从而促进肺纤维化的发生。该研究还揭示了白介素-17B调控肺纤维化病理发生的分子机制及其作为治疗肺纤维化疾病新的靶点的应用潜能。
粘膜微生态一直是当前免疫学领域的研究热点,它已经被证明广泛参与多种粘膜组织免疫稳态的维持以及相关疾病的发生。该团队多年来围绕粘膜微生态与白介素-17家族细胞因子做了一系列研究工作,一方面肠癌发生过程中紊乱的微生态菌群可以通过调控IL-17C的产生促进肠癌的发生(Song, et al., Immunity, 2014),另一方面肠道中微生态菌群也可以通过调控IL-17A的分泌促进肠道损伤修复(Song, et al., Immunity, 2015)。尽管如此,目前我们对肺组织中微生态的功能尚知之甚少。
通过高通量测序等手段研究人员发现在正常小鼠肺组织中也存在着相对丰富的微生态菌群,而在肺纤维化病理组织中菌群发生明显紊乱,并且紊乱的肺部菌群对肺纤维化的发生至关重要。接下来的研究发现肺部菌群可以通过诱导IL-17B的表达促进肺纤维化的发生。抗生素清除肺部菌群的小鼠、无菌小鼠以及IL-17B缺失的小鼠都表现出肺纤维化减轻的表型。进一步研究鉴定发现Bacteroides和Prevotella两个属的细菌在肺纤维化过程中明显升高,并且可以通过分泌OMVs促进IL-17B的分泌。利用骨髓移植、细胞分选等实验手段研究发现IL-17B主要由肺泡巨噬细胞产生,并且发现OMVs是通过其携带的脂多糖和脂蛋白等成分作用于肺泡巨噬细胞的TLR2、TLR4受体激活下游Myd88介导的信号从而促进IL-17B的表达。此外,研究发现IL-17B可以直接作用于肺部上皮细胞诱导下游基因的表达从而促进中性粒细胞的招募以及Th17细胞的分化最终促进肺纤维化的发生。
综上所述,该研究揭示了肺部菌群在调节肺粘膜相关疾病尤其是肺纤维化中的功能及其作用机制,为临床治疗相关疾病提供了新的思路和治疗靶点。
中国科学院上海营养与健康研究所博士后杨大平为论文第一作者,钱友存研究员为通讯作者。该研究得到了哈佛医学院博士后宋昕阳、生化所陈江野研究员、上海免疫所王宏林教授以及上海曙光医院宝山分院李莉医生的帮助和支持。经费支持来自于国家自然科学基金委、科技部、中国科学院等,同时该研究得到上海营养与健康研究所公共技术平台和动物平台的支持和帮助。
图注:肺组织中异常升高的微生物菌群通过分泌OMVs调控巨噬细胞IL-17B的产生从而促进肺纤维化病理发生。
新闻来源:中国科学院上海营养与健康研究所
参考文献:Yang D, Chen X, Wang J, Lou Q, Lou Y, Li L, Wang H, Chen J, Wu M, Song X, Qian Y. Dysregulated Lung Commensal Bacteria Drive Interleukin-17B Production to Promote Pulmonary Fibrosis through Their Outer Membrane Vesicles. Immunity. 2019 Feb 15. pii: S1074-7613(19)30046-9. doi: 10.1016/j.immuni.2019.02.001. [Epub ahead of print]