作者:企鹅
转移是导致癌症患者死亡的主要原因。由于转移生物学的高度复杂性导致癌症晚期转移阶段的临床选择仍然有限,导致药物开发效率低和治疗结果差。乳腺癌是女性中最常见的癌症,也是全球死亡的主要原因,尽管有手术治疗结合晚期放疗和化疗,但每年仍有高达50万人死亡。
外泌体是50-150 nm的小细胞外囊泡(sEV),其含有蛋白质、脂质、RNA和DNA,并且在各种生理和病理途径中充当细胞-细胞通信的重要介质。癌细胞衍生的sEV在转移部位以及原发性肿瘤中创造有利的微环境。因此,这些恶性sEV在循环系统中的清除已成为抗转移药物开发的一种新颖且可能有用的治疗策略。许多报道已经证明,通过使用化学抑制剂、基因工程或抗体实现的sEV分泌(或分泌的sEV)的减少可以提高癌症化学疗法的效率并抑制癌症转移。然而,如前所述,需要进一步的工作来确定这些抑制剂是否可以影响其他EV或可溶性蛋白质的分泌,或供体细胞的病理生理学特征。此外,已经鉴定的可以控制外泌体生物发生和分泌的抑制剂的潜在机制尚未清楚阐明,而它们的安全性/毒性特征未知。
药物再利用是寻找现有药物新适应症的过程,是一种更快、更便宜、更安全的药物开发策略。在该过程中,新适应症可以源自原始药物的相同靶标或新识别的靶标。药物再利用的一个显著优势是管理机构批准的药物已经通过了人体毒性和安全性测试。开发抑制sEV分泌的新药的主要问题之一是毒性,当候选药物抑制癌细胞分泌sEV时,可能是由于正常细胞外泌体分泌的任何部分或暂时抑制引起的。该研究作者相信药物再利用可以通过在鉴定和开发作为新型抗癌治疗剂的新的sEV分泌抑制剂期间节省宝贵的时间和益处来降低失败的风险。
在这项研究中,通过筛选FDA批准的药物库,确定了口服抗菌药物磺胺异恶唑(SFX)作为乳腺癌细胞生物发生和分泌sEV的特异性抑制剂,从而有效抑制乳腺癌生长和转移无明显毒性。此外,该研究发现内皮素受体A(endothelin receptor A, ETA)是GPCR家族的成员,与乳腺癌细胞中的sEV生物发生和分泌密切相关,并且ETA是新发现的SFX靶标。
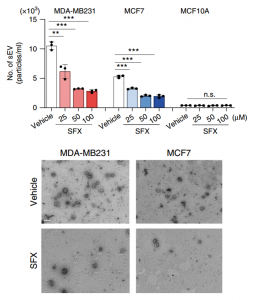
SFX抑制乳腺癌细胞外泌体分泌
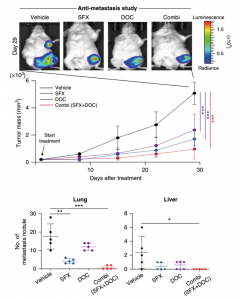
癌症外泌体促进癌症进展和转移,其分泌的抑制剂的开发不仅可以加速外泌体生物学研究,还可以为癌症患者提供治疗益处。该研究发现磺胺异恶唑(SFX)可通过干扰内皮素受体A(ETA)从而作为乳腺癌细胞分泌小细胞外囊泡(sEV)的抑制剂。SFX是FDA批准的口服抗生素,在乳腺癌异种移植小鼠模型中显示出显著的抗肿瘤和抗转移作用,参与sEV生物合成和分泌的蛋白质表达降低,并引发多囊泡内体与溶酶体的共定位降解。通过直接结合分析、药理学和遗传学方法,通过ETA蛋白的功能获得和功能丧失研究证明了ETA作为SFX靶标的重要作用。
SFX抑制了乳腺癌的生长和转移
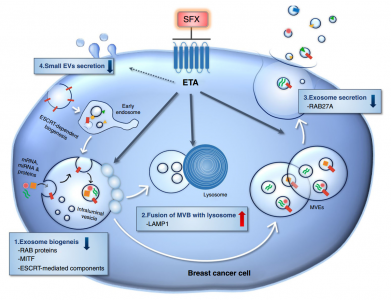
该研究发现SFX脱靶的ETA与sEV生物发生和分泌相关,并且这一发现将通过对sEV生物发生的调节的机制研究加速一类新药物的开发或分泌物。此外,SFX和ETA拮抗剂可干扰ETA功能,抑制sEV的分泌,并从癌细胞中改变sEV货物的组分,从而有助于抗癌作用。因此,这些与ETA相关的SFX结果是新颖的并且对于临床意义非常重要,尽管仅测试了SFX和ETA拮抗剂在乳腺癌细胞中的作用。研究人员预计这些化合物也可能通过阻止sEV生物合成和分泌而有益地影响其他类型的癌细胞,尽管这需要通过未来的实验来证实。
SFX介导的MDA-MB231癌细胞中sEV分泌抑制的模式图。SFX通过ETA结合和随后的干扰,降低了参与sEV生物合成和分泌的蛋白质的表达,增加了MVE与溶酶体的融合,最终减少了乳腺癌细胞分泌的sEV的数量。
参考文献:
Eun-Ju Im, Chan-Hyeong Lee, Pyong-Gon Moon, Gunassekaran Gowri Rangaswamy, Byungheon Lee, Jae Man Lee, Jae-Chul Lee, Jun-Goo Jee, Jong-Sup Bae, Taeg-Kyu Kwon, Keon-Wook Kang, Myeong-Seon Jeong, Joo-Eun Lee, Hyun-Suk Jung, Hyun-Joo Ro, Sangmi Jun, Wonku Kang, Seung-Yong Seo, Young-Eun Cho, Byoung-Joon Song & Moon-Chang Baek. Sulfisoxazole inhibits the secretion of small extracellular vesicles by targeting the endothelin receptor A. Nature Communications volume 10, Article number: 1387 (2019) |