土豆
获得性耐药的出现是胶质母细胞瘤临床治疗的障碍之一,然而对这种耐药性的发生分子机制知之甚少。近日,来自南京医科大学附属第一医院尤永平课题组的研究人员发现,lncRNA SBF2-AS1在外泌体中富集,并促进了胶质母细胞瘤的替莫唑胺耐药性。该研究发表于4月16日的Journal of Experimental & Clinical Cancer Research杂志上(IF 6.217)。
恶性神经胶质瘤是大脑最常见的原发性恶性肿瘤,也是成人最致命的肿瘤类型之一。烷基化药物替莫唑胺(temozolomide,TMZ)是治疗多形性胶质母细胞瘤(GBM)的国际标准化疗药物。然而,TMZ的耐药性以及伴随的肿瘤复发已成为GBM临床治疗中的难题和关键问题。因此,探索TMZ获得性耐药的潜在机制可为GBM治疗提供有希望的新分子靶点。
外泌体是目前已知研究最为透彻的细胞外囊泡,直径范围为40 nm至100 nm,可以从多种细胞类型中释放,如T淋巴细胞、神经元细胞和GBM细胞等肿瘤细胞。目前科学家们越来越关注外泌体潜在的诊断和治疗价值,特别是在肿瘤中的应用备受关注。一般而言,大多数关于肿瘤耐药性的研究都集中在肿瘤细胞本身,例如,遗传改变促使化疗药物失活、癌基因异常活化、肿瘤抑制基因失活、肿瘤异质性发展以及凋亡机制缺陷等,从而造成了肿瘤的耐药性。由肿瘤细胞分泌的外泌体充当了肿瘤细胞之间或者微环境中的各类细胞之间通信的关键介质。因此,外泌体已成为肿瘤耐药性研究的新模式,也成为了肿瘤生物学耐药性研究的新热点。
长链非编码RNA(lncRNA)是长度超过200个核苷酸的非编码RNA。研究表明,长链非编码RNA在肿瘤细胞中异常表达,并与肿瘤进展相关,包括细胞凋亡、代谢、增殖和转移等。Salmena研究团队首先提出lncRNA可以作为一种竞争性的内源性RNA(ceRNA),lncRNA通过miRNA海绵抑制miRNA靶向mRNA的水平。基于这一假设,“lncRNA-miRNA-mRNA”轴已在包括GBM的多种肿瘤中进行了探索和验证。然而,ceRNA网络在GBM进展中的作用,尤其是对耐药性的影响尚不清楚。
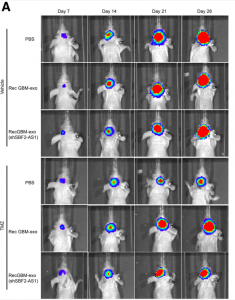
在本研究中,研究人员采用了以下策略对外泌体lncRNA在GBM耐药性发生过程中的作用机制进行研究。通过qRT-PCR和FISH检测,分析TMZ耐药以及TMZ敏感的GBM组织细胞中的LncSBF2-AS1水平。通过一系列体外试验和异种移植肿瘤模型,检测lncSBF2-AS1对GBM TMZ耐药性的影响。通过CHIP实验研究SBF2-AS1和转录因子蛋白ZEB1之间的相关性。通过双荧光素酶报告基因检测、RNA免疫沉淀(RIP)、免疫荧光和蛋白质印迹,验证lncSBF2-AS1、miR-151a-3p和XRCC4之间的关系。通过彗星分析法和免疫印迹阐明lncSBF2-AS1对DNA双链损伤修复的影响。通过体外试验和颅内异种移植肿瘤模型确定外泌体lncSBF2-AS1的功能。
研究结果发现,lncRNA SBF2-AS1在TMZ耐药的GBM细胞和组织中上调,并且SBF2-AS1的过表达导致TMZ的耐药性,而抑制SBF2-AS1会使耐药性GBM细胞对TMZ敏感。转录因子ZEB1直接结合SBF2-AS1启动子区域,调节SBF2-AS1水平并影响GBM细胞中的TMZ耐药性。机制上,SBF2-AS1作为miR-151a-3p的ceRNA发挥作用,使miR-151a-3p对其内源靶标XRCC4的抑制作用减弱,增强GBM细胞中的DNA损伤修复。TMZ耐药的GBM细胞分泌的外泌体中包含高水平的SBF2-AS1,并且向敏感GBM细胞传播TMZ耐药性。临床实验结果显示,血清外泌体中高水平的lncSBF2-AS1与GBM患者对TMZ治疗的不良反应相关。
研究人员认为,GBM细胞通过分泌富含lncSBF2-AS1的外泌体来重编程肿瘤微环境,促进了肿瘤的化疗耐药性。因此,血清中的外泌体lncSBF2-AS1可以作为耐药性或难治性GBM的潜在诊断标志物。
图:外泌体lncSBF2-AS1增强GBM对TMZ的化疗耐药性
参考文献:Zhang Z, Yin J, Lu C, Wei Y, Zeng A, You Y. Exosomal transfer of long non-coding RNA SBF2-AS1 enhances chemoresistance to temozolomide in glioblastoma. J Exp Clin Cancer Res. 2019 Apr 16;38(1):166.