肿瘤相关成纤维细胞(CAF)在肿瘤微环境中对肿瘤进展中起关键作用,然而,结直肠癌转移和化疗耐药与CAF之间的关系仍待明确。近日,来自南方医科大学梁莉课题组的研究人员在Molecular Cancer(IF 7.776)杂志上发表文章,发现CAF分泌的外泌体可促进结直肠癌的转移和化疗耐药,通过抑制CAF外泌体的miR-92a-3p可以逆转肿瘤耐药性。
结直肠癌(CRC)是全球第三大常见的恶性肿瘤,也是全球癌症相关死亡的第四大原因。由于门静脉的引流作用,结直肠癌的肝转移是CRC患者死亡的最常见形式和主要原因。虽然肝转移的CRC患者在通过氟尿嘧啶和铂类化疗初期效果较好,但大多数患者后期会转变为获得性耐药导致化疗耐药,中位生存期仅为约20个月。然而,CRC转移和化疗耐药的机制仍不清楚。
越来越多的证据表明肿瘤细胞与肿瘤微环境(TME)周围基质细胞之间的细胞相互作用在调节肿瘤进展和治疗反应中起重要作用。CAF是TME的重要成分,可以与肿瘤细胞相互作用促进肿瘤发生和进展。随着CAF与肿瘤之间关系的逐渐被阐明,CAF现在被认为是抗肿瘤治疗的潜在目标。然而,CAFs促进肿瘤转移和化疗耐药的机制、以及CAF与肿瘤细胞之间的通讯仍有待研究。
外泌体是由脂质双层膜组成的微囊泡,含有各种生物活性分子,包括DNA、microRNA、蛋白质和脂质等。细胞分泌的外泌体可在TME中转移遗传信息,作为肿瘤细胞和基质细胞间通讯之间的重要介质。微小RNA(miRNA)是一类18-22个核苷酸的小单链非编码RNA分子,通过与mRNA的互补3'非翻译区(UTR)结合促进mRNA切割和降解。越来越多的证据表明,miRNA参与细胞增殖、分化、代谢和凋亡的调节。然而,外泌体在调节肿瘤细胞中miRNA表达改变和功能变化方面的机制仍有待探索。
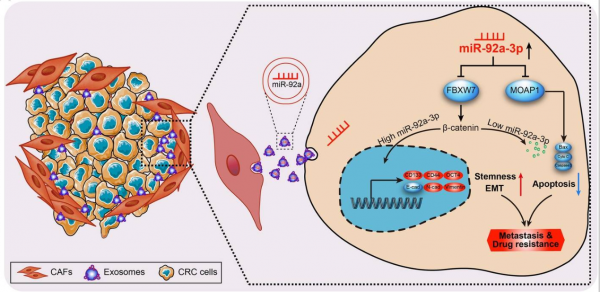
在这项研究中,研究人员发现外泌体会增加CRC细胞中的miR-92a-3p的表达,CAFs通过该路径促进CRC细胞的干性、EMT、转移和化疗抗性。研究人员从新鲜的CRC和邻近的正常组织中获取了CAF和NFs。然后从条件培养基和CRC患者血清中分离外泌体,并通过透射电子显微镜、纳米和蛋白质印迹进行表征。通过MicroRNA微阵列鉴定了由CAF或NF分泌的外泌体中差异表达的miRNA。免疫荧光法观察了外泌体被肿瘤细胞的摄取以及miR-92a-3p的细胞间转移。迁移和侵袭实验、CCK-8、流式细胞术、平板菌落形成、微球体形成实验等结果显示,CAFs促进CRC细胞的干细胞形成、上皮间质转化(EMT)、肿瘤转移和化疗耐药。重要的是,CAF通过直接将外泌体转移至CRC细胞发挥其作用,导致CRC细胞中miR-92a-3p水平的显著增加。CRC细胞中miR-92a-3p的表达增加,激活Wnt /β-catenin途径并直接抑制FBXW7和MOAP1,最终抑制线粒体相关的凋亡,从而促进肿瘤进展和化疗抗性。临床水平上,miR-92a-3p表达与FBXW7和MOAP1水平呈负相关,血清中外泌体miR-92a-3p的高表达与CRC患者的转移和化疗耐药密切相关。因此,研究人员认为,CAF分泌的外泌体可促进CRC的转移和化疗耐药,抑制外泌体miR-92a-3p能够预测CRC转移并为提高化疗敏感性提供了一种方法。
参考文献:Hu JL, Wang W, Lan XL, Zeng ZC, Liang YS, Yan YR, Song FY, Wang FF, Zhu XH, Liao WJ, Liao WT, Ding YQ, Liang L. CAFs secreted exosomes promote metastasis and chemotherapy resistance by enhancing cell stemness and epithelial-mesenchymal transition in colorectal cancer. Mol Cancer. 2019 May 7;18(1):91.