土豆
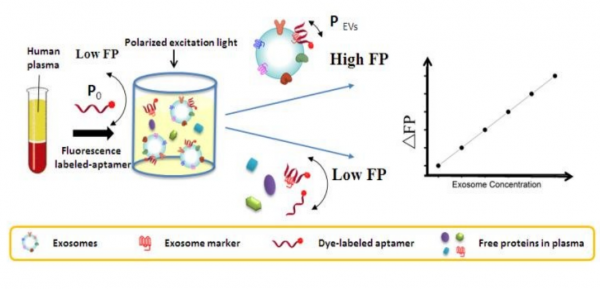
图:用于外泌体定量的基于适体的荧光偏振检测的示意图(AFPExo)。
肿瘤来源的外泌体作为有价值的生物标志物,对非侵入性肿瘤诊断和治疗监测意义重大。然而,由于识别特异性和分离效率低下,临床样品(例如血液)中外泌体的鉴定和定量仍是个挑战。近日,来自中国科学院化学研究所、分子纳米结构与纳米技术重点实验室方晓红和张振课题组的研究人员开发了一种名为AFPExo的基于荧光偏振检测外泌体的方法,该方法可以在少于1μL的血浆样本中进行外泌体定量分析。该研究发表于Nanoscale(IF 7.233)杂志上。
细胞外囊泡(EV)是由几乎所有细胞类型包括肿瘤细胞主动分泌的纳米级膜囊泡。这些囊泡在细胞间通讯中起重要作用,能够将蛋白质、mRNA / miRNA、DNA和脂质转移到受体细胞。根据EV的生物遗传多样性,EV主要被分类为外泌体(30-100nm)、微泡(100-1000nm)和凋亡小体。外泌体由于其高稳定性、代表了亲本细胞的特性以及在诸如各种癌症的相关作用而受到越来越多的关注。外泌体被认为是用于癌症诊断和预后的新型非侵入性生物标志物,提供了一种检测肿瘤分子信息的微创途径,监测肿瘤进展和治疗有效性。因此,开发一种简单且高灵敏度的外泌体检测方法对于改善肿瘤诊断和治疗具有重要的临床意义。
外泌体在生物样品测定中属于相对较新的物质,具有独特的物理和生物学特征,例如包含高度异质的生物分子、尺寸范围为30-100nm,远小于细胞(10-30μm),但比普通生物分子要大。这些特征并不具有特异性,因此外泌体的分离和检测难度很大。目前,常用的外泌体定量方法是基于纳米颗粒跟踪分析(NTA)和qNano技术,但需要先将外泌体进行分离和纯化,并且要将外泌体与杂质颗粒(例如蛋白质聚集体和脂蛋白)区分开。除此之外,已广泛开发了各种方法用于分析体液(例如血液、尿液、唾液)中的外泌体,例如电化学和光学测定,这也需要大量纯化或分离外泌体的步骤(例如超速离心、磁珠、芯片等)。实际上,外泌体的分离纯化方法有一些缺陷,例如来自血浆或血清中的外泌体的在分离后通常纯度不高,操作复杂且耗时。最重要的是,外泌体提取时的损失是一个主要问题。据估计,使用基于超速离心的方法,来自粘性体液(例如血浆和血清)的外泌体的回收率仅为5-25%,而超速离心被认为是迄今为止外泌体分离中的金标准。其他基于免疫捕获的提取方法,例如酶联免疫吸附测定(ELISA),利用固定在固相表面上的抗体/适体捕获和分离外泌体,捕获产率可能高于25%,这取决于抗体/适体对外泌体特定蛋白质的亲和力。然而,这些分离纯化过程里的外泌体损失终究无法避免。
上述的方法都属于非均相测定,而均相测定不需要分离和洗涤步骤,因此处理方便并具有更好的准确性和再现性。然而,小体积的外泌体无法在光学显微镜下进行定量。非囊泡来源的生物标志物和其他类型的囊泡在生物体液中共存,这严重干扰了外泌体检测并阻碍了生物标志物特异性外泌体分析。为了克服这些问题,之前Yoshioka等人报道了一种名为ExoScreen的发光邻近均相测定,用于血清中的外泌体检测。该测定基于AlphaLISA技术,该技术需要两种类型的免疫光敏剂珠子(供体beads和受体beads),二者距离仅在200nm内会激发荧光。因此,仅当供体beads和受体beads同时结合位于单个外泌体(直径<200nm)上的两个单独抗原时才能检测到信号,而抗原单体(例如游离的生物标记物)不会产生荧光信号。然而,ExoScreen测定需要两种类型的专用免疫光敏剂珠子和特殊的仪器。
与其他荧光信号传导方法相比,荧光偏振(Fluorescence polarization,FP)测定具有一些独特的优点。在FP测定中,不需要猝灭剂或供体受体配对,这简化了探针设计。此外,FP是一种比率法,对样品荧光波动和光漂白不敏感。由于这些优点,FP测定已广泛用于药物研发、生化分析和临床诊断。大多数FP测定基于靶标结合时荧光偏振物质的分子体积或质量的变化。因此,已经广泛研究了使用纳米颗粒的基于质量放大的FP测定的开发。质量放大的纳米材料可以极大地提高测定灵敏度,因此比传统的基于大分子(例如蛋白质)的FP灵敏度更高。
受纳米材料放大策略的启发,由于外泌体的大小类似于纳米材料荧光偏振放大器,研究人员开发了一种基于适体的荧光偏振测定用于外泌体定量,这是一种无需分离、无需扩增且高灵敏度的方法,可以直接定量人血浆中的外泌体,研究人员将其命名为AFPExo测定。该测定方法利用了外泌体的双重性质,即用于荧光偏振放大的大质量或体积以及可被特定低分子量适体识别的表面抗原。适体是由称为SELEX的能结合蛋白质的短的单链寡核苷酸片段,尺寸很小(适体平均10kDa,抗体一般要超过150kDa),对外泌体膜上的靶蛋白具有高亲和力,并且可以用荧光染料进行标记。因此,染料标记的适体与外泌体的结合将显著改变适体的分子量,导致荧光偏振信号变化。利用该方法,研究人员可以在每μL体液中定量分析5×102到5×105个颗粒的外泌体,对于肿瘤细胞直接来源的外泌体,检测上限为500个颗粒/μL。更重要的是,由于荧光偏振受环境干扰的影响较小,人体血浆中的外泌体检测时不需要任何繁琐的样品预处理。研究人员从肺癌患者和健康供体的临床样本中的外泌体进行了定量验证。这项工作描述了一种新的简单的液体活检检测方法,可直接检测生物体液中的外泌体,从而促进肿瘤诊断和治疗监测。
参考文献:Zhang Z, Tang C, Zhao L, Xu L, Zhou W, Dong Z, Yang Y, Xie Q, Fang X. Aptamer-based fluorescence polarization assay for separation-free exosome quantification. Nanoscale. 2019 May 28;11(20):10106-10113.