作者:企鹅
干细胞有望治疗多种疾病。正在进行的700多项间充质干细胞(MSC)临床试验中,包括治疗自身免疫疾病和神经退行性疾病。然而,使用MSCs的临床前研究和临床试验的效果不是太好,部分原因是对其作用机制(MOA)的理解有限。MSC领域中的一个特殊难题是在全身移植后,由于它们的尺寸大,MSC很快被滞留在肺血管系统中;通常小于1%的MSC能到达靶位点,但是经常能观察到治疗效果。目前人们将MSC的治疗功能主要归因于旁分泌效应。研究人员推断,体内原位移植细胞产生的细胞外囊泡(EVs)可能是干细胞促进远端部位组织重塑和再生的机制。实际上,最近的几项研究表明,EVs可以通过多种机制调节免疫系统,MSC衍生的EVs具有治疗功能。
为了解析移植干细胞的治疗机制,并开发基于外泌体的纳米治疗剂治疗自身免疫性疾病和神经退行性疾病,来自加利福尼亚大学欧文分校的Weian Zhao教授在ACS Nano(影响因子13.709)发表文章,使用实验性自身免疫性脑脊髓炎(EAE)小鼠模型评估了人间充质干细胞(MSCs)分泌的外泌体在治疗多发性硬化症中的作用。
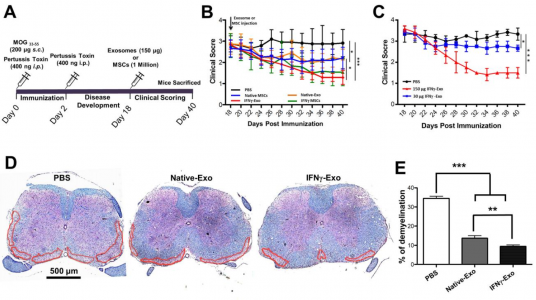
MSC外泌体改善EAE小鼠的临床评分和相关的神经学参数。A)诱导EAE和治疗(外泌体或MSCs)方法的示意图,小鼠在第18天接受临床评分直至第40天;B)PBS、天然MSC和IFNγ刺激的MSC及其外泌体注射后,EAE小鼠的临床评分;C)使用两种剂量外泌体进行剂量研究,并将结果与PBS对照进行比较;D)卢卡斯快蓝染色的代表性脊髓切片,虚线表示白质损坏区域;E)不同组中脱髓鞘区域的定量。
为了将EVs作为无细胞疗法开发并阐明它们在干细胞体内作用中的潜在机制,该研究评估了从MSCs释放的外泌体(MSC-外泌体)治疗破坏性自身免疫和神经退行性疾病,特别是多发性硬化症(MS)。MS是中枢神经系统(CNS)的炎性疾病,其可导致脱髓鞘、神经元损伤和丧失,并最终导致神经功能障碍,目前是医疗保健系统的重大负担。
研究发现静脉注射由IFNγ刺激的MSCs产生的外泌体(IFNγ-Exo)(i)与PBS对照相比降低了EAE小鼠的平均临床评分;(ii)脱髓鞘减少;(iii)神经炎症减少;(iv)上调EAE小鼠脊髓内CD4+CD25+FOXP3+调节性T细胞(Tregs)的数量。
IFNγ-Exo与体外活化的外周血单核细胞(PBMCs)细胞的共培养降低了PBMC增殖和促炎性Th1和Th17细胞因子的水平,包括IL-6、IL-12p70、IL-17AF和IL-22,而免疫抑制细胞因子吲哚胺2,3-双加氧酶水平升高。IFNγ-Exo还可以在小鼠脾细胞培养物中体外诱导Tregs,可能由第三方辅助细胞类型介导。
此外,通过深度RNA测序表明IFNγ-Exo含有抗炎RNAs,抑制这些RNAs可部分抑制外泌体诱导Tregs的潜力。此外,还发现IFNγ-Exo含有多种抗炎和神经保护蛋白。这些结果不仅揭示了干细胞治疗机制,而且提供了证据证明MSC外泌体作为无细胞疗法用于治疗自身免疫和中枢神经系统疾病的潜力。
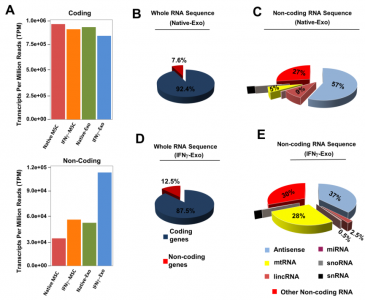
天然MSC,IFNγ-MSC及其外泌体的RNA全转录组深度测序分析。A)MSC及其外来体的蛋白质编码转录物(mRNA)和非编码转录物;B)Native-Exo的全RNA序列概述;C)Native-Exo的非编码RNA序列概述(不同类型的非编码RNA的百分比);D)IFNγ-Exo的全RNA序列概述;E)IFNγ-Exo的非编码RNA序列概述(不同类型的非编码RNA的百分比)。
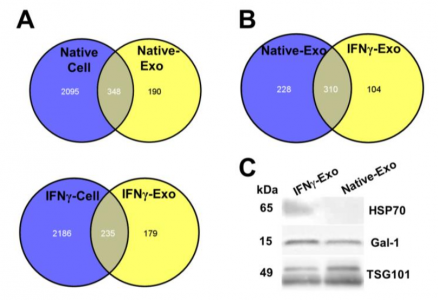
MSCs和外泌体的蛋白质组学。A)天然和IFNγ-MSC及其相应的外泌体的蛋白质组成的比较;B)Native-Exo和IFNγ-Exo的蛋白质组成的比较;C)与Native-Exo相比, IFNγ-Exo富含HSP70和Gal-1。
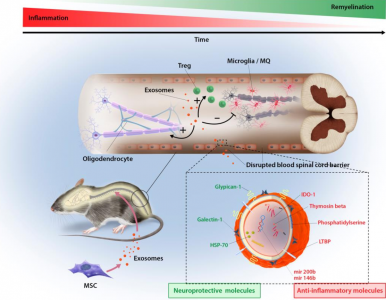
总之,研究发现IFNγ-Exo的全身注射可产生持续的临床恢复,同时使EAE小鼠的运动技能改善,神经炎症减少和脱髓鞘减少。该研究有助于了解移植干细胞的治疗机制,并提供基于无细胞外泌体的治疗平台,以治疗MS或其他自身免疫和神经退行性疾病。
MSC上清收集
将80% confluent的细胞与15%去外泌体的FBS的完全培养基一起培养3天。为了去外泌体,将FBS以120,000×g离心18小时。但是,作者提醒不同的方案可能导致FBS外泌体去除的效率。
外泌体的分离
- 将MSC的条件培养基(有或没有IFNγ处理)以300×g离心10分钟以除去细胞或大细胞碎片。然后收集上清液并转移至超速离心管(Polyallomer Quick-Seal centrifuge tubes 25×89 mm, Beckman Coulter)。
- 使用超速离心机(Optima L-90 K or Optima XE- 90 Ultracentrifuge, Beckman Coulter)以16,500×g(Type Ti 45, Beckman Coulter)离心20分钟,以除去微泡。
- 小心地收集上清液并用Type 45 Ti转子在4℃以120,000×g离心5小时。将外泌体沉淀用PBS溶解并储存在-80℃。
- 对于RNA测序和蛋白质组学实验,汇集从四个不同MSC批次制备的外泌体,以减少批次间差异的潜在影响。
MSC外泌体介导的EAE恢复机制模式图
参考文献:
Riazifar M, Mohammadi MR, Pone EJ, Yeri A, Lässer C, Segaliny AI, McIntyre LL, Shelke GV, Hutchins E, Hamamoto A, Calle EN, Crescitelli R, Liao W, Pham V, Yin Y, Jayaraman J, Lakey JRT, Walsh CM, Van Keuren-Jensen K, Lotvall J, Zhao W. Stem Cell-Derived Exosomes as Nanotherapeutics for Autoimmune and Neurodegenerative Disorders. ACS Nano. 2019 May 29. doi: 10.1021/acsnano.9b01004. [Epub ahead of print]