土豆
大自噬(Macroautophagy)和自噬(Autophagy)过程受阻与肝纤维化的发病密切相关。然而,异常的自噬过程如何促进纤维化此前尚不清楚。来自中国医学科学院药物研究所胡卓伟课题组在Autophagy杂志(IF 11.059)发表文章,揭示了TRIB3与SQSTM1相互作用介导的自噬受阻在肝纤维化发生中的机制,并提出了一种治疗纤维增生性肝病有吸引力的治疗策略。
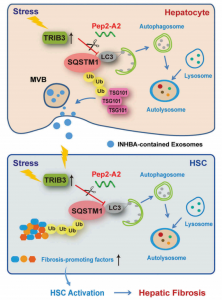
肝纤维化是病毒性肝炎、酒精性和胆汁淤积性肝病等多种慢性肝病发病时的重要结构基础。尽管近年来在肝纤维化的发病机理方面取得了很大进展,但有效的抗肝纤维化和抗肝硬化药物仍然是药物开发中的难点。据报道,大自噬(Macroautophagy)和自噬(Autophagy)是一种细胞自消化过程,对于维持营养不良和不同细胞应激期间的细胞和组织稳态非常重要,涉及组织损伤修复和纤维化的调节。与介导单一短寿蛋白质降解的泛素蛋白酶体系统(UPS)不同,自噬参与了长寿蛋白和细胞器(如线粒体、内质网和核糖体)的大规模降解过程。此外,自噬还向细胞外释放不需要的或受损的细胞质成分,这个过程具有重要意义,可能对邻近细胞产生有益或有害作用。在自噬期间,自噬体可以与溶酶体融合或与多泡体(MVB)融合,而后者是含有多个腔内囊泡的晚期胞内体,最终导致溶酶体中的内容物被降解。如果自噬溶酶体途径受阻,那么MVB将与质膜融合并以外泌体的形式释放到细胞外。
当自噬降解受阻时,外泌体分泌是减轻细胞内物质压力的最常见替代途径。在肝脏中,一些含有miRNA的外泌体通过调节肝星状细胞(HSC)活化参与肝纤维化的发病机制。相反,来自脐带间充质细胞的外泌体通过抑制肝细胞中的SMAD信号通路减弱小鼠的肝纤维化。该研究团队此前证实,肝细胞自噬抑制参与胆管结扎(BDL)或硫代乙酰胺(TAA)以IL17A依赖性方式诱导的肝纤维化的发病机制,并且阻断IL17A在肝纤维化的小鼠模型中得到治疗作用。然而,尚未确定特异性外泌体是否可以从自噬受损的肝细胞中释放,或在肝纤维发生中起重要作用的HSC是否受这些外泌体的调节。
研究团此前的研究表明,TRIB3(tribbles pseudokinase 3)作为一种应激蛋白,可以在多种应激条件下表达上调。TRIB3直接与货物受体SQSTM1 / p62(sequestosome 1)相互作用,并干扰其与MAP1LC3 / LC3的结合并参与泛素化底物蛋白,这一过程抑制自噬通量并保护几种肿瘤转化因子在肿瘤细胞中的免受自噬降解。然而,TRIB3表达升高是否会在实质肝细胞和HSC中引起异常的自噬活性,或者高TRIB3表达是否有助于肝纤维化的进展,这些在此前都是未知的。
在本研究中,研究人员旨在阐明促纤维化的应激蛋白TRIB3介导的自噬功能障碍的过程。研究人员从进行过外科手术的肝硬化患者上获得人纤维化肝组织。同时在由胆管结扎(BDL)或硫代乙酰胺(TAA)注射诱导的肝纤维化的小鼠模型中评估TRIB3的功能和意义。结果发现,人纤维化肝组织比非纤维化组织表达的TRIB3表达更高,选择性自噬受体SQSTM1 / p62表达更高,并且TRIB3和SQSTM1的表达升高在纤维化组织中呈正相关。沉默TRIB3可以保护实验小鼠免受肝纤维化,并伴随着纤维化肝组织中自噬活性的恢复。此外,TRIB3与SQSTM1相互作用阻碍其与MAP1LC3 / LC3的结合,导致SQSTM1聚集体的积累和自噬通量受阻。TRIB3介导的自噬受阻不仅抑制晚期胞内体的自噬降解,而且还促进富含INHBA/Activin A的外泌体从肝细胞中分泌,引起肝星状细胞(HSC)的迁移、增殖和活化。阻断TRIB3-SQSTM1相互作用恢复肝细胞和HSC中的自噬通量,对肝纤维化产生有效的保护作用。研究结果证实,应激升高的TRIB3表达通过与SQSTM1相互作用,并干扰SQSTM1在肝实质细胞中的功能并激活HSC而促进肝纤维化。靶向TRIB3-SQSTM1相互作用将是治疗纤维增生性肝病的有前景的策略。
参考文献:Zhang XW, Zhou JC, Peng D, Hua F, Li K, Yu JJ, Lv XX, Cui B, Liu SS, Yu JM, Wang F, Jin CC, Yang ZN, Zhao CX, Hou XY, Huang B, Hu ZW. Disrupting the TRIB3-SQSTM1 interaction reduces liver fibrosis by restoring autophagy and suppressing exosome-mediated HSC activation. Autophagy. 2019 Jul 9:1-14.
外泌体资讯网 Autophagy:阻断TRIB3-SQSTM1相互作用可恢复自噬并抑制外泌体介导的HSC活化,实现肝纤维化的治疗