作者:企鹅
心血管疾病(CVD)仍然是全球发病率和死亡率的主要原因。尽管管理方面取得了重大进展,但心脏病仍是一种进展性疾病。一旦心肌细胞受损,它们就不能被有效替换,导致心脏功能下降。在功能上显著的心肌梗塞之后,估计有10亿个心肌细胞丢失。没有坏死的区域和心梗边缘区中剩余的心肌细胞可能变得过载和肥大,导致最终的病理性重塑和心力衰竭。除局部缺血诱导的细胞坏死外,心肌细胞也会在心力衰竭、缺血再灌注和非缺血性心肌病中通过细胞凋亡和自噬而大量死亡。尽管进行了大量的临床前期和早期临床试验,移植的干细胞在宿主心肌中大量驻留、形成功能性成体心肌细胞分化、与宿主心肌整合的能力是有限的。因此,靶向改善内源性心肌细胞或是调节随后心脏重塑的有吸引力的手段。
尽管当前已经开发了多种药物递送系统以实现优异的药物治疗效果,但是,这些系统中的大多数仍然具有生物相容性问题。因此,与合成药物递送系统相比,作为生物携带的外泌体被认为是生物相容的,可生物降解的并且对环境安全。在生物学上,外泌体被认为是生物活性物质的天然载体,并且它们参与细胞信号传导和通信的转运。关于外泌体的生物来源,它们可以通过自上而下的细胞工程技术产生。因此,它们被认为是没有环境危害的绿色药物输送系统。在这方面,外泌体被认为是有希望的药物递送系统。
各种干细胞衍生的外泌体显示出心血管生物活性,使其成为潜在的心脏病的无细胞治疗方法。来自心肌球源细胞(CDC)的外泌体已经显示出在心脏病动物模型中重现CDC的治疗效果。CDC外泌体包含一系列心脏保护性货物,已被证明可刺激血管生成、诱导内源性心肌细胞增殖,并调节心肌细胞凋亡和肥大。当注射到缺血再灌注的动物模型中时,CDC衍生的外泌体减少梗塞面积并改善左心室功能。
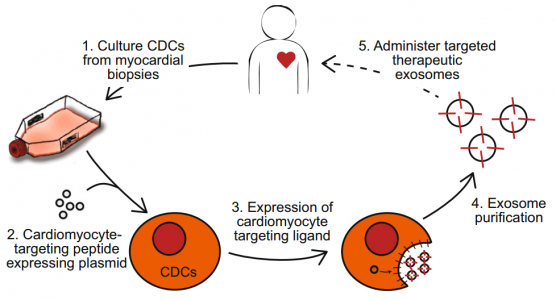
尽管在纯化和浓缩剂量下观察到了效力,但外泌体的治疗潜力在很大程度上受其生物分布的限制。除少数例外,大多数天然分泌的外泌体对特定细胞类型表现出有限的靶向性。近期发表于Scientific Reports的一篇研究寻求通过在其外泌体表面上控制表达心肌细胞靶向肽(CMP)来增强心肌细胞来源的细胞外泌体的心肌细胞内吞作用。为了达到这个目的,研究人员将心肌细胞特异性肽连接到Lamp2b的外泌体外N末端。靶向心肌细胞的CDC外泌体显示体外对心肌细胞的摄取增加,心肌细胞凋亡减少和体内心脏驻留增强,突出了该递送系统靶向特定细胞群的特异性和能力。
此前,Theranostics上的一篇研究还报道过利用心脏归巢肽将具有再生促进能力的外泌体靶向到心肌梗塞处(见参考文献3)。
关于外泌体靶向性改造的文章,您还可以关注:
- 药物递送,如何提高细胞外囊泡的靶向性?(https://www.exosomemed.com/5954.html)
- 经双配体化学编辑的外泌体在微流控纯化后可有效靶向递送药物至肿瘤细胞(https://www.exosomemed.com/3364.html)
- 外泌体与靶向给药(https://www.exosomemed.com/2021.html)
更多信息您可以上外泌体资讯网(www.exosomemed.com)检索查看。
参考文献:
- Mentkowski KI, Lang JK. Exosomes Engineered to Express a Cardiomyocyte Binding Peptide Demonstrate Improved Cardiac Retention in Vivo. Sci Rep. 2019 Jul 11;9(1):10041. doi: 10.1038/s41598-019-46407-1.
- Sherif AY, Harisa GI, Alanazi FK, Youssof AME. Engineering of exosomes: Steps towards green production of drug delivery systems. Curr Drug Targets. 2019 Jul 14. doi: 10.2174/1389450120666190715104100. [Epub ahead of print]
- Vandergriff, A., et al. (2018). "Targeting regenerative exosomes to myocardial infarction using cardiac homing peptide." Theranostics 8(7): 1869-1878.
外泌体资讯网 携带心肌细胞结合肽的外泌体显示出更好的心脏驻留