土豆
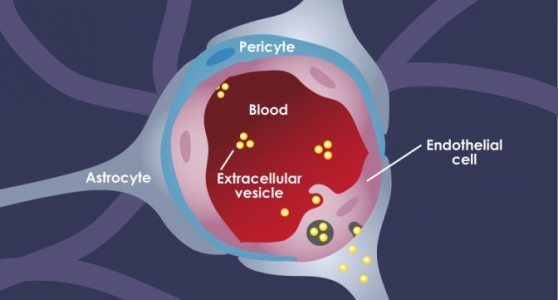
图:细胞外囊泡,也被称为外泌体,可通过转胞吞作用穿越血脑屏障(ACS Nano 2019; doi.org/10.1021/acsnano.9b04397)
转移性乳腺癌通常会以骨骼、肺部和大脑作为定植点,其中脑转移最为危险,许多女性在确诊乳腺癌脑转移后存活期不到一年。那么,乳腺癌如何通过血脑屏障?它可以被阻止吗?
来自美国波士顿儿童医院的博士生Golnaz Morad和她的导师Marsha Moses博士对外泌体(也称为细胞外囊泡或EV)以及外泌体在乳腺癌脑转移中的作用进行了深入研究。他们将这项令人惊讶的发现发表在近期的ACS Nano杂志上(IF=13.903)。
“Golnaz确定了EV通过血脑屏障并提供转移前微环境的机制,使乳腺癌细胞可以转移到大脑。”波士顿儿童医院血管生物学项目的负责人Moses博士说。他们实验是主要研究方向是女性癌症的发生机制。。
现在他们知道了外泌体的这种机制,Moses和Morad希望找到可以阻止乳腺癌发生脑转移的治疗目标。
EV和癌症
简而言之,EV是由细胞释放的微小囊泡,包含了其来源细胞希望传达出去的化学信息。就癌细胞而言,EV携带的内容物有助于为原发肿瘤及其转移创造一个更好的环境,正如Moses和Morad最近在一篇综述文章中描述的那样(J Extracell Vesicles. 2019; 8(1): 1627164)。原发性肿瘤可以将EV分泌到循环系统中,使外泌体播散到远处的器官并帮助传播和转移肿瘤细胞。
“我们面临的主要问题是,EV如何首先进入大脑?”Morad说。 “血脑屏障不允许大于400道尔顿的任何物质被动地进入脑组织。外泌体可比这个最大限度大了两倍多。”
图:Marsha Moses博士与Golnaz Morad。Moses实验室对女性癌症特别感兴趣。
“劫持”转胞吞作用
血脑屏障(BBB)是由三种细胞组成的复杂结构。在血液中行进的EV首先遇到紧密连接的脑内皮细胞。下一层是周皮细胞,其次是星形胶质细胞。细胞之间的通讯使得整个BBB结构变得紧凑:星形胶质细胞和周皮细胞向内皮细胞发送信息以收紧交界处。
Morad、Moses及其同事使用了几种BBB模型,包括BBB的体外微流体模型(“芯片上的BBB”),以及静态体外模型、活体斑马鱼和小鼠模型。 Donald Ingber博士和Leonard Zon博士的实验室分别合作开发了BBB芯片模型和斑马鱼模型。Moses实验室还与哈佛大学Christopher Carman博士实验室合作。Chan School of Public Health为本研究提供了高分辨率成像。
每种模型和技术都有各自的理论。在这项研究里,Morad和Moses第一次表明,EV不是穿过BBB中的细胞再挤进大脑,而是诱骗内皮细胞去吸收这些EV。这种被称为转胞吞作用的标准生物途径,由细胞简单直接地吞噬EV,将EV带入组织内部然后像特洛伊木马一样再将它们释放到脑组织中。
“EV还可以控制内皮细胞,帮助自身穿过BBB,”Morad说。“这些EV劫持了分子摄取和分选的途径,并改变了细胞内部通路的调节。”
Moses实验室正在进行的工作表明,一旦EV突破BBB障碍,它们就会诱使星形胶质细胞向周围环境发送信号,使其更容易接受肿瘤生长。利用质谱和其他技术对这些信号进行了筛查,确定了一些已知会降解蛋白质网络的信号,这些信号为脑细胞提供结构和生化支持。
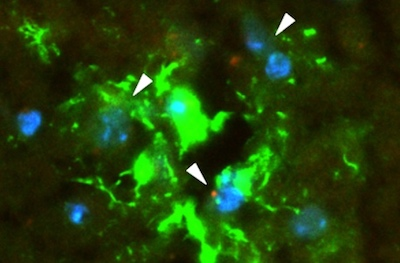
图:肿瘤来源的外泌体(红色)穿过血脑屏障并被小鼠脑组织中的星形胶质细胞(绿色)吸收。(ACS Nano 2019; doi.org/10.1021/acsnano.9b04397)
EV作为抗癌治疗的运输工具?
对于这项研究,Morad必须开发出特殊的方法来大量收集EV并验证它们的特性。
“这些EV非常重要,但要获得足够的EV量是非常具有挑战性的。”Moses说。
Moses实验室已经发现EV可以通过什么途径来促进乳腺癌脑转移,他们希望能够扭转这一现象,即通过EV向转移部位输送抗癌药物。这项工作正在进行中。
文章摘要:
参考文献:
- http://discoveries.childrenshospital.org/breast-to-brain-metastasis-exosomes-bbb
- Morad G, Carman CV, Hagedorn EJ, Perlin JR, Zon LI, Mustafaoglu N, Park TE, Ingber DE, Daisy CC, Moses MA. (2019) Tumor-Derived Extracellular Vesicles Breach the Intact Blood-Brain Barrier via Transcytosis. ACS Nano [Epub ahead of print].