神经元到(星形)胶质细胞的通讯对于中枢神经系统(CNS)中的功能性突触传递和生理学是必不可少的。尽管星形胶质细胞在突触功能中具有重要的调节作用,但调节神经元-星形胶质细胞功能单元的分子途径在很大程度上是不确定的。在发育过程中,神经元衍生的配体(例如,JAG1、DLL1和最近的neurexins)与星形胶质细胞Notch或neuroligins相互作用以控制星形胶质细胞分化和形态发生。神经元谷氨酸能活性也涉及调节重要的星形胶质细胞突触蛋白的表达,例如主要的谷氨酸转运蛋白GLT1和连接蛋白。在成人大脑中,星形胶质细胞策略性地定位在神经元突触附近以感知神经元活动的变化,主要通过它们的表面受体到突触前释放的神经递质,并通过周围突触形态变化和信号释放(称为转移的过程)来响应积极调节突触传递。
外泌体(直径50-150 nm)是一种主要类型的分泌型细胞外囊泡(EV),来自早期内体区室内的腔内囊泡(ILV),并在内体成熟过程中从细胞中释放。从各种CNS细胞类型分泌的EV和外泌体已经成为CNS中新颖且重要的细胞间通讯途径。以前表明,皮层神经元分泌含miR-124的外泌体,上调培养物中星形胶质细胞GLT1的表达。海马神经元还分泌EV,促进arc mRNA转移到受体神经元并参与活动依赖性翻译。在无脊椎动物模型生物中也发现了EV介导的细胞间信号传导,这可以通过将Wingless(Wg)从突触小体转移到蝇幼虫的神经肌肉接头(NMJ)中的特化肌肉区子突触网(SSR)来证明。外泌体信号传导也与CNS的病理状况有关,包括神经损伤、神经退行性疾病和胶质母细胞瘤。
微小RNA(miR)是一类具有20-25个核苷酸长度的非编码RNA,调节主要器官系统(包括CNS)中的发育和疾病过程。尽管miR通常在产生它们的细胞中调节基因功能,但是在EV,尤其是外泌体中经常发现miR,在细胞之间穿梭以进行细胞间信号转导。已经在CNS细胞中观察到miR的细胞间转移以调节谷氨酸转运蛋白,促进髓鞘形成,并维持脑血管完整性。与EV相关的miR也具有作为一系列神经疾病的新型生物标志物的潜力。值得注意的是,目前对CNS细胞中外泌体信号传导的理解主要限于培养模型。来自CNS细胞的分泌的EVs/exosomes内的特定成分才刚刚开始被了解。该研究开发了一种新的小鼠模型来说明体内和体外的细胞内ILV和细胞外外泌体。在分泌的神经元外泌体中鉴定了miR并确定它们在转移到星形胶质细胞后如何发挥非细胞自主遗传调节作用。
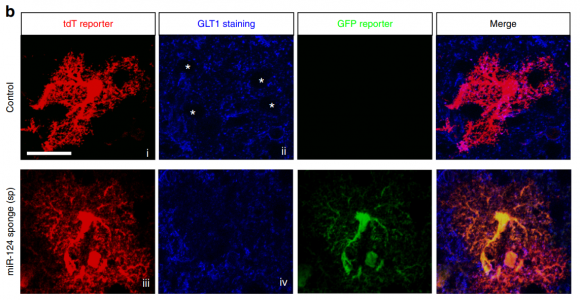
来自对照和GFP-miR-124-sp注射的eeat2-tdT星形胶质细胞报告小鼠的皮质星形胶质细胞的代表性结果
该研究通过生成细胞类型特异性ILV/外泌体报告基因(CD63-GFPf/ f)小鼠和免疫EM /共聚焦图像分析,发现体外和体内神经元CD63-GFP+ILV主要定位于体细胞和树突,但不在轴突末端。分泌的神经元外泌体含有miR,不同于神经元的miR谱。这些miR,特别是神经元特异性miR-124-3p,可能被内化到星形胶质细胞中。MiR-124-3p通过抑制GLT1的抑制性miR进一步上调主要的谷氨酸转运蛋白GLT1。研究结果表明先前未描述的神经元外泌体miR介导的星形胶质细胞功能的遗传调节,可能开启了理解CNS细胞间通讯的新前沿。
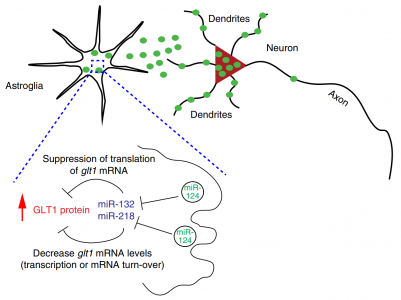
外泌体miR-124-3p在神经元到星形胶质细胞通讯中的示意图。绿色实心圆圈:神经元分泌的外泌体;在该模型中,含有miR-124-3p的神经元外泌体通过体细胞释放、内化到星形胶质细胞中进而遗传抑制下游miR而增加GLT1蛋白。
参考文献:
Men Y, Yelick J, Jin S, Tian Y, Chiang MSR, Higashimori H, Brown E, Jarvis R, Yang Y. Exosome reporter mice reveal the involvement of exosomes in mediating neuron to astroglia communication in the CNS. Nat Commun. 2019 Sep 12;10(1):4136. doi: 10.1038/s41467-019-11534-w.