作者:企鹅
还记得那篇对外泌体领域发展起里程碑作用的“Exosome-mediated transfer of mRNAs and microRNAs is a novel mechanism of genetic exchange between cells”文章吗?该文的第一作者Hadi Valadi教授近日在Nature Communications杂志上发表文章,报道了LNP-mRNA进入胞内体后如何逃离被降解的命运——装载到细胞外囊泡中,进而递送到其他细胞。
基于RNA的治疗药物通过递送siRNA沉默病理基因或通过将外源mRNA递送至细胞来表达治疗性蛋白质,在治疗各种疾病方面具有巨大潜力。RNA治疗为多种疾病提供了潜在的新治疗选择,并且已经在包括癌症、传染病和各种遗传病在内的多种疾病的临床试验中进行了测试。然而,RNA疗法也面临着巨大的挑战。例如,由于核酸酶的存在,RNA在细胞外液中非常不稳定,而且mRNA/siRNA需要被正确的细胞吸收,并且必须能够逃脱内体以转运到胞质溶胶中进行蛋白质表达或发挥基因沉默作用。mRNA修饰可以在一定程度上增加稳定性。然而,将mRNA/siRNA转运至受体细胞的细胞质需要安全、有效的转运载体。
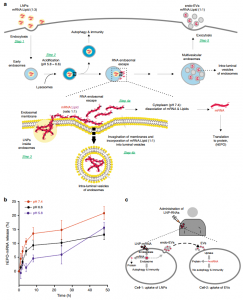
脂质纳米颗粒(LNPs)目前代表着最先进的RNA输送平台,现已进入人类临床试验,其mRNA递送的安全性已在人类和非人灵长类动物中进行了评估。LNP介导的mRNA递送已在非人类灵长类动物的法布里氏病(X连锁溶酶体贮积病)的临床前研究、以及弗里德里希共济失调和甲基丙二酸血症的疾病模型、柠檬酸缺乏的鼠模型中的代谢和行为异常、针对Zika和流感病毒的免疫原性的临床前和临床试验中进行了检验。然而,它们避免被内体吸收的能力有限,限制了LNP作为RNA递送载体的使用,因为只有一小部分RNA有效逃离了内体到达细胞质。大部分LNP(95%)在半小时内被细胞内吞(摄取),但据估计,通过LNP施用的siRNA的<2%逃脱了内体到达胞质溶胶。然而,LNP递送的RNA为何只有少量摆脱内体到达细胞质仍然还不清楚。
细胞外囊泡(EVs)是纳米和微米大小的异质囊泡类群,包括微囊泡、外泌体和其他几种EV类。描述最充分的EVs是外泌体(40-120 nm),其起源于内体,并通过胞吐途径分泌。细胞的成分可被分选到晚期内体的腔内囊泡中(也称为多囊泡体,MVB)。然后,在MVB与质膜融合后,外泌体释放到细胞外环境中。
在2007年,Hadi Valadi教授首次证明了EV包含大量RNAs,并且EV作为基因交换的一种机制在细胞之间转运RNA。由于EVs充当细胞之间RNA转移的内源载体,因此这些囊泡可被定制为siRNA传递载体。EVs可以调解器官之间的通讯并在各个器官之间运送细胞货物。因此,EVs有望成为基于siRNA疗法的体内递送载体。然而,由于其体积小,将外源mRNA插入EVs中仍然具有挑战性。
该报道研究了编码人促红细胞生成素(hEPO蛋白)的LNP传递的修饰mRNA以及LNP的可电离阳离子脂质成分(DLin-MC3-DMA和DLin-DMA)的细胞内命运。通过LNP施用的siRNA摆脱内体的比例<2%,研究假设定位于内体的LNP材料的其余部分,即hEPO-mRNA和可电离脂质,可以整合到晚期内体的腔内囊泡中,并可能随后作为外泌体分泌到细胞外环境中。该研究将LNP-mRNA内吞后分泌的EV称为endo-EVs。
研究表明,LNP成分(mRNA和可电离的脂质)部分进入了endo-EVs,并且以1:1的摩尔比(mRNA核苷酸:可电离的脂质)检测到了外源递送的mRNA。即,mRNA应该被可电离的阳离子脂质中和,以使mRNA从带负电荷的内体膜逃逸到细胞质。这些endo-EVs在体内运输到器官的过程中保护外源mRNA,并将完整的hEPO-mRNA传递到受体细胞的细胞质中。更重要的是,所传递的mRNA具有功能并在小鼠中产生人EPO蛋白。尽管EV和LNP的全身递送都引起小鼠促炎性细胞因子的表达,但由EV诱导的表达水平不如LNP高。
作者相信,这些数据可能会影响替代性生物载体的生产,这些载体可用于传递mRNA来表达遗传性疾病宿主中不存在的蛋白质,如本文所例举的编码hEPO的hEPO mRNA的传递,hEPO是治疗各种贫血疾病的重要分泌蛋白。
解释LNP内体命运的假设机制示意图
参考文献:
Maugeri M, Nawaz M, Papadimitriou A, Angerfors A, Camponeschi A, Na M, Hölttä M, Skantze P, Johansson S, Sundqvist M, Lindquist J, Kjellman T, Mårtensson IL, Jin T, Sunnerhagen P, Östman S, Lindfors L, Valadi H. Linkage between endosomal escape of LNP-mRNA and loading into EVs for transport to other cells. Nature Communications. 2019 Sep 24;10(1):4333. doi: 10.1038/s41467-019-12275-6.