作者:企鹅
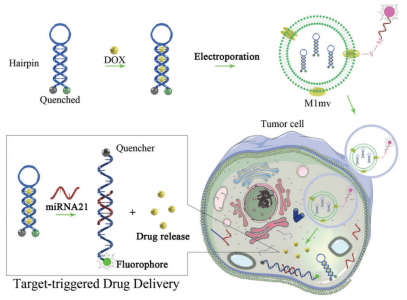
近日,中山大学第五附属医院黄曦教授、廖玉辉教授在Small杂志(影响因子10.856)上发表文章,将功能化的DNA工程化为铰链,将量子点(QD)锚定在外泌体表面上,从而实现了适度且生物相容的标记策略。QDs标记的外泌体(外泌体-DNA-QDs复合物)可以被肿瘤细胞迅速吞噬,可用作肿瘤标记的特异性试剂。此外,通过气动脂质体挤出机构建了工程化的M1巨噬细胞人工囊泡(M1mv),并构建了一个目标触发的药物递送系统,以实现针对特定miRNA响应的肿瘤可视化治疗的递送系统。这些策略促进了外泌体/囊泡的适度标记和功能化,并构建了同时具有生物治疗和化学治疗功能的人工药物输送囊泡,因此有可能成为肿瘤标记和治疗的新方案。
外泌体是细胞外囊泡(EVs)的重要组成部分。这些囊泡(30-150 nm)是交流的信息载体,调节细胞之间的膜交换、细胞分化和发育的生理过程,也参与诸如心血管疾病等病理过程、肿瘤或神经退行性病变,甚至是致病因子的转移。近年来,很多报道已经讨论了来自各种细胞类型的外泌体的潜在生物学功能。在证明了外泌体在抗原呈递细胞中的功能和体内免疫反应后,人们对外泌体的关注日益增加。有关外泌体的全面研究使有效的标记策略成为在亚细胞和细胞水平进行观察的迫切需求。
外泌体的现有标记方法包括化学修饰、适体亲和力、两亲性分子插入和内源性方法。化学修饰依赖于外泌体和标记剂之间的共价键,提供了外泌体标记的简单方法,伴随着激烈的化学反应和有机荧光团的低量子产率。适体的亲和力适中,但是由于适体的亲和力极大地依赖于溶液环境,因此不能应付复杂的环境。两亲性分子插入和内源性方法需要在细胞培养物中添加标记剂。经过特殊处理的细胞分泌的外泌体的生物学特性尚不确定,因为在细胞培养物中人工添加的试剂可能带来不可预测的影响。因此,为外泌体开发适度、稳定和有效的标记策略具有重要意义。
巯基广泛分布在包括膜蛋白在内的大多数蛋白中。它可以通过巯基和马来酰亚胺之间的生物相容性相互连接(在磷酸盐缓冲盐溶液中反应)来用作外泌体标记的结合位点。受纳米成像技术的飞速发展的启发,量子点(QD)被用作标记发光体。但是,量子点的大粒径(≈10 nm)会引起很大的空间位阻。为了克服这一限制,对DNA铰链(功能化DNA)进行了改造,使其作为将QD锚定在外泌体表面的韧带。该策略实现了一种温和且生物相容的外泌体标记方法,该方法由于量子点的量子产率较高而获得了强大的荧光发射益处。通过这种标记策略,该研究发现标记在肿瘤来源的外泌体(外泌体-DNA-QDs复合体)上的QD可以被肿瘤细胞迅速吞噬。外泌体-DNA-QD的荧光点亮了肿瘤细胞。该结果表明,外泌体-DNA-QD可以用作肿瘤成像的特异性药物。此外,外泌体的囊泡内部空间为药物治疗提供了无限可能,而不仅仅是肿瘤标记和成像。
然而,外泌体的低分离产率极大地限制了它们的实际应用。因此,该研究试图通过用气动脂质体挤出机将M1巨噬细胞挤压出来,从而以优异的囊泡生成率来构建人工囊泡(M1mv)。同时,结果有趣地表明,M1mv具有杀死肿瘤细胞的能力,实现了对肿瘤细胞的理想的生物损伤。为了进一步提高抗肿瘤功效和药物释放的特异性,该研究构建了一个目标触发的药物递送系统,以实现一种特定的miRNA响应系统,用于肿瘤的可视治疗。在该试验中,将阿霉素(DOX)插入功能化的DNA探针中,并通过细胞内miRNA-21的触发将其释放,miRNA-21是在大多数肿瘤细胞中高表达的特征性生物标志物。通过M1mv实现了可成像的靶向肿瘤治疗。因此,这些策略实现了外泌体/囊泡的适度标记和功能化,构建了同时具有生物学治疗和化学治疗功能的工程化药物递送囊泡,因此有可能成为肿瘤成像和治疗的新范例。
参考文献:
Fan Z, Xiao K, Lin J, Liao Y, Huang X. Functionalized DNA Enables Programming Exosomes/Vesicles for Tumor Imaging and Therapy. Small. 2019 Oct 15:e1903761. doi: 10.1002/smll.201903761. [Epub ahead of print]