作者:企鹅
近日,军事医学科学院放射与辐射医学研究所分子诊断实验室肖瑞教授与首都医科大学、安徽农业大学的研究人员合作在Biosensors and Bioelectronics杂志(影响因子9.518)上发表文章,报道了一种基于Fe3O4@TiO2分离和SERS免疫检测相结合的方法,可以在40分钟内实现1个PD-L1+外泌体/μL的检测极限。利用该方法检测4 μL临床血清样品,可从健康对照样本中区分出非小细胞肺癌患者样本。该方法或可促进揭示外泌体PD-L1与免疫疗法在个体水平上的反应关系。
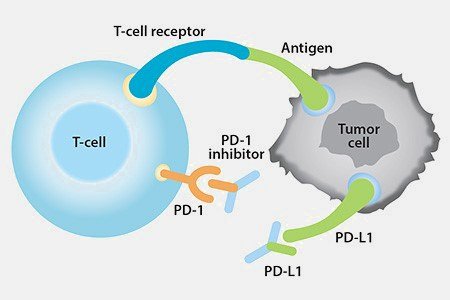
癌症是导致死亡的最主要原因之一,是全球范围内的一种重要公共疾病。目前,癌症的主流疗法包括手术切除、放疗和化学疗法,其抗肿瘤功效有限,特别是对于晚期癌症。这些年来,免疫疗法彻底改变了癌症疗法。程序性死亡配体1(PD-L1)是肿瘤细胞与T细胞免疫检查点结合的最重要分子之一。针对PD-L1和PD-1的免疫检查点蛋白抑制剂抗体即使在晚期也已显示出对多种类型癌症的有效性,例如黑色素瘤、非小细胞肺癌和肾癌。然而,只有不到30%的患者表现出对抗PD-L1/PD-1治疗的持久治疗反应,而对于其他癌症,例如前列腺癌,这种反应却很少见。考虑到免疫药物的高价和副作用,迫切需要对抗PD-L1/PD-1治疗进行个性化反应的预先估计。如今,肿瘤组织PD-L1表达检测被用于筛选患者对抗PD-L1/PD-1治疗的反应。但是,由于难以采集肿瘤组织的样本,难以实现实时监视。另一方面,对于单个患者的疗效预测,结果也不令人满意。例如,在几乎所有的临床试验中,一些肿瘤组织PD-L1阴性但对免疫治疗有反应的患者,以及一些肿瘤组织PD-L1强烈阳性的患者根本没有反应。
最近,有一些有意思的报道揭示了外泌体PD-L1和抗PD-L1/PD-1治疗的相关性。2018年,郭巍教授和徐小威教授在《自然》杂志上发表了一篇报道,证明转移性黑色素瘤外泌体PD-L1有助于免疫抑制并与抗PD-1反应相关(相关报道:https://www.exosomemed.com/4924.html )。治疗前,循环外泌体PD-L1水平较低的转移性黑素瘤患者对抗PD-L1 / PD-1治疗表现出积极的临床反应。Chiocca研究小组在2018年Science advances杂志中报道,胶质母细胞瘤外泌体PD-L1可以直接与T细胞的PD-1结合以诱导免疫抑制,从而直接耗尽T细胞并阻断抗PD-1治疗。此外,来自胶质母细胞瘤患者的外泌体PD-L1与最大60 cm3的肿瘤体积呈正相关,支持外泌体PD-L1作为肿瘤患者生物标志物的潜力。2019年,Blelloch研究小组在Cell杂志中报道,外泌体PD-L1较低的黑色素瘤患者对PD-L1/PD-1治疗的阳性反应比表达高水平PD-L1的前列腺癌患者更积极(相关报道:https://www.exosomemed.com/5751.html )。由于循环外泌体PD-L1可以抑制T细胞活性以诱导免疫抑制,并且对抗PD-L1/PD-1治疗,因此可以预期外泌体PD-L1可作为抗PD-1治疗临床结果的预测指标以及肿瘤负担的生物标志物。通过对每位患者进行循环外泌体PD-L1液体活检,对PD-L1/PD-1治疗的反应和癌症的情况进行预测。然而,由于高异质性和小尺寸(30-200 nm),从复杂的生物样品中高效分离外泌体和进行高灵敏度的下游蛋白质分析仍然是循环检测外泌体PD-L1的两个障碍。
PD-L1/PD-1在肿瘤免疫中的作用模式图
常规的外泌体蛋白质测定包括基于超速离心的分离以及下游Western blot和ELISA分子表征。尽管是最广泛使用的金标准,超速离心方法仍存在许多缺点,例如笨重且昂贵的仪器,耗时且回收率低(5-25%)。Western blot需要复杂的蛋白质裂解物制备,并且超过48小时的处理时间,每次测定都消耗了大量的生物流体样品(> 2 mL血浆)。一对非相互作用抗体所需的ELISA可以提高检测特异性,但使开发新的检测方法和执行同时的多重测量变得困难。此外,蛋白质印迹法和ELISA法都具有相似的ng/mL检测限,很难在癌症的早期阶段检测到非常低的外泌体PD-L1丰度。
富集和分离的外泌体的免疫亲和磁珠通过其特定的蛋白质标记得到样品。它适用于现场即时诊断,因为它的分离过程简单快速,但是这些方法经常遭受重现性低和外泌体产量低(<50%),然而,使用抗体作为最初的外泌体分离方法会引入选择步骤,该选择步骤可能只是得到外泌体的“亚群”,因此,对于诊断至关重要的一些信息可能会被忽略。2018年,Wan组开发了脂质磁性纳米颗粒,通过脂质尾巴与脂质体磷脂膜之间的相互作用来捕获脂质体,可以捕获异质性脂质体,然后在15分钟内通过磁体分离,效率为50%。2019年,Qian组报告了基于TiO2微球的血清外泌体分离,分离效率高达93.4%。然而,TiO2 /外泌体洗涤和从血清分离的过程仍需要几个超速离心过程,这容易使外泌体丢失。此外,下游LC-MS/MS蛋白质分析方法需要大量蛋白质,因此无法大规模用于单个外泌体PD-L1水平的检测。
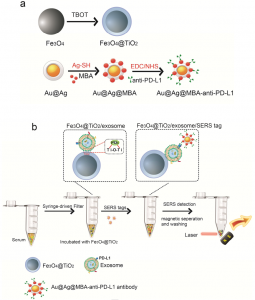
模式图
在这项研究中,军事医学科学院放射与辐射医学研究所分子诊断实验室肖瑞教授等开发了一种新的策略,用于高速分离循环外泌体并从临床样品中精确检测外泌体PD-L1生物标志物。首先,设计了Fe3O4@TiO2纳米颗粒用于外泌体的分离。通过TiO2与外泌体磷脂的亲水性磷酸根结合,可以任意捕获外泌体。捕获后,可以在20 s内用磁铁将Fe3O4@TiO2/外泌体从血清中分离出来。其次,通过表面增强拉曼散射(SERS)免疫分析法分析了外泌体PD-L1生物标志物。SERS光谱可以提供具有高灵敏度和稳定性的“指纹”信息。最近,一些研究人员专注于用于外泌体蛋白质生物标志物定性分析的标记或无标记SERS技术。这项研究设计了一种抗PD-L1抗体修饰的“Au@Ag@MBA”SERS标签,用于外泌体PD-L1标记和SERS检测。MBA用作拉曼信号报告基因,其特征峰在拉曼位移的1074 cm-1处。
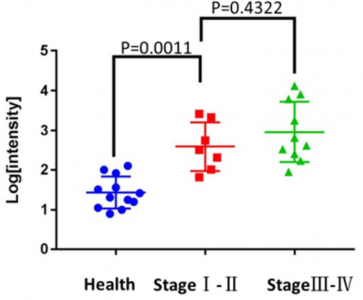
通过SERS系统测量的对照组和早期(I/II期)和晚期(III/IV期)癌症患者血清样品中PD-L1水平的散点图
与微流控的无抗体反应方法相比,脂质磁性纳米颗粒和TiO2微粒用于外泌体分离,Fe3O4@TiO2纳米颗粒具有高捕获效率、快速磁性分离能力和非常低的成本。在这项研究中,腺癌人类肺泡基底上皮细胞(A549)衍生的外泌体被用作模型样本,因为已经证明外泌体PD-L1水平不仅与肺癌的分期密切相关,而且也与黑色素瘤和NSCLC中抗PD-1抗体的反应有关。
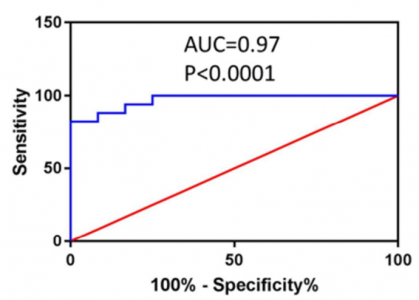
ROC分析以评估从健康对照(n=12)中检测出NSCLC病例(n=17)的诊断能力
首先,用Fe3O4@TiO2捕获临床血清的外泌体,并用磁铁将其与溶液分离。其次,添加SERS标签以标记外泌体的PD-L1生物标志。PD-L1水平可以通过SERS标签的特征峰1074 cm-1的SERS强度进行定量。将此系统用于临床环境中的外泌体PD-L1分析。根据该策略,仅需使用4 µL临床血清样品即可精确定量外泌体PD-L1,整个过程可在40分钟内完成。根据SERS信号分析,可以清楚地区分健康供体、早期NSCLC患者和晚期NSCLC患者的外泌体PD-L1水平。这是Fe3O4@TiO2和SERS标签首次联合用于生物流体中的外泌体富集和蛋白质生物标志物检测。更重要的是,通过使用该系统,可以在治疗之前和之后实时监测个体的外泌体PD-L1水平。该策略将帮助医生研究外泌体PD-L1水平和癌症状况的关系,并预测免疫疗法在个体水平上的反应。
要点:
- 设计了Fe3O4@TiO2纳米颗粒用于循环外泌体的捕获和分离,在5分钟内的捕获效率为5%。
- 抗PD-L1抗体修饰的Au@Ag@MBA被设计为SERS标签,用于外泌体PD-L1标记和精确定量。
- 基于Fe3O4@TiO2分离和SERS免疫检测的结合,可以在40 min内实现1个PD-L1+外泌体/μL的检测极限。
- 基于所述个性化SERS信号分析,非小细胞肺癌患者可从健康对照通过使用4 μL临床血清样品区分开来。明确个体量化的优势可能有助于医生发现外泌体PD-L1与免疫疗法在个体水平上的反应关系。
参考文献:
Yuanfeng Pang, Jinmaio Shi, Xingsheng Yang, Chongwen Wang, Zhiwei Sun, RuiXiao. Personalized detection of circling exosomal PD-L1 based on Fe3O4@TiO2 isolation and SERS immunoassay. Biosensors and Bioelectronics Available online 25 October 2019, 111800 In Press. DOI: 10.1016/j.bios.2019.111800