格拉纳达大学的研究员Belén Rubio Ruiz是本研究的作者之一
来自格拉纳达和萨拉戈萨大学以及英国爱丁堡癌症研究中心的研究人员开发了一种新的抗癌工具。
这项研究最近发表在著名的《Nature Catalysis》杂志上,该研究将钯催化剂直接通过微小囊泡(即外泌体)输送到内部的癌细胞中,从原位激活化学治疗药物。
“特洛伊木马”
格拉纳达大学(UGR)、阿拉贡纳米科学研究院(INA)、萨拉戈萨大学以及爱丁堡癌症研究中心的研究人员创建了这种新工具,使用“特洛伊木马”从肿瘤细胞自身内部瓦解自己而不破坏健康组织。
研究人员使用外泌体作为“特洛伊木马”,将钯(Pd)催化剂输送到癌细胞中。“我们将钯催化剂引入大小约为100纳米的微小囊泡或外泌体中,这些囊泡或外泌体能够在肿瘤细胞内部传播。”萨拉戈萨大学的Jesús Santamaría教授解释说,他们与爱丁堡大学的Asier Unciti-Broceta博士一起领导了这项研究并最终发表在《Nature Catalysis》杂志上。
杀死癌细胞很简单,很多化学毒性分子都可以完成这个工作。但是,最重要的挑战是仅将毒性分子靶向癌细胞,而不是健康细胞。常规的这些抗癌药物缺乏细胞特异性是导致癌症患者在化疗期间产生各种副作用的原因。与其将这些药物注射到血液中,不如直接在肿瘤细胞内部产生这些药物会更好。这正是本研究中这些科学家团队所取得的成就。
“我们在日常生活的许多方面都使用催化剂,因为它们会帮助原本不可能发生的化学反应的进行。例如,我们汽车排放的气体会通过催化剂进行处理,从而减少对环境和健康的危害。” Belén Rubio Ruiz评论说。因此,令人惊奇的是,在肿瘤领域,催化剂的作用实际上是闻所未闻的。“这是因为在其中存在着巨大的障碍:确定合适的催化剂和反应,最重要的是,将催化剂直接传递到靶细胞,而不是其他细胞。”
外泌体是关键因素
外泌体在这里可能被证明是关键因素。外泌体由大多数细胞分泌,并被含有其所起源细胞特征性物质的膜包围。这使得它们具有选择性,并使它们即使在存在其他细胞的情况下也可以优先对来源细胞进行治疗。
该研究的作者找到了一种方法,可以在肿瘤细胞外泌体内诱导催化剂(厚度超过一纳米的钯纳米片)的合成,而不会干扰其外膜的特性,从而将外泌体转化为能够将催化剂传递给祖细胞的工具。到达祖细胞中后,它们会催化抗癌化合物的原位合成(该研究中使用的是panobinostat,2015年批准的抗癌药物)。
这项研究中证明了这一过程的有效性之后,研究人员观察到:“我们收集了将要治疗的相同类型的癌细胞的外泌体,在其中装载了钯催化剂,然后将它们放回培养基中。在那里,由于它们的选择性向性,外泌体将催化剂传递至原始细胞。一旦进入内部,催化剂就会将非活性的panobinostat转化为活性和有毒的形式,从而在我们想要的位置杀死肿瘤细胞,杀死的位置就在肿瘤细胞内部。”
该过程的关键是外泌体介导的转运机制的选择性。由于这种选择性,panobinostat仅在有催化剂的细胞内产生,因此优先引起原始肿瘤细胞的死亡,而其他细胞的死亡率则低得多。
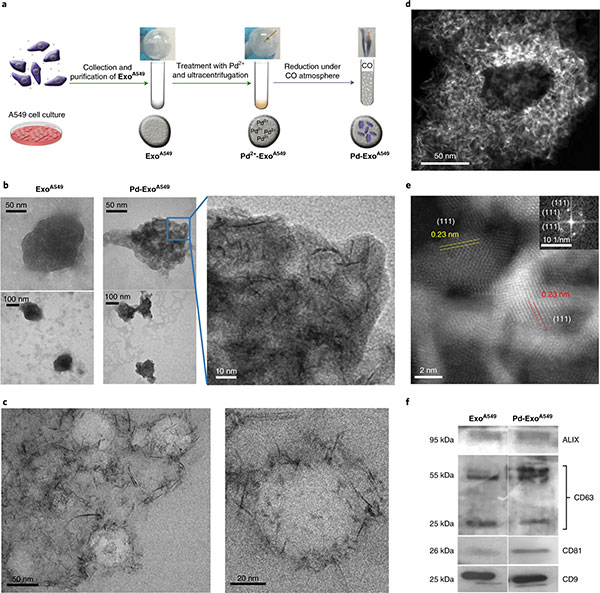
图:钯功能化外泌体的制备与表征
参考文献:
- Sancho-Albero M, Rubio-Ruiz B, Pérez-López AM, Sebastián V, Martín-Duque P, Arruebo M, Santamaría J, Unciti-Broceta A. Cancer-derived exosomes loaded with ultrathin palladium nanosheets for targeted bioorthogonal catalysis. Nature Catalysis 2(10):864-872.
- https://www.ugr.es/en/about/news/scientists-successfully-deliver-trojan-horse-catalysts-cancerous-tumour-cells-destroy





