土豆
包括外泌体在内的细胞外囊泡(EV)可以在生理和病理条件下充当细胞与细胞之间的通讯介质。来自第四军医大学韩骅课题组的研究人员在Cell Death and Disease杂志上发表文章,发现缺血再灌注损伤下的神经元可以通过上调Cav-1来增加其存活率,并增加EC来源的EV/外泌体的摄入,最终减缓神经元凋亡。
中风是全球居民的主要健康威胁之一,死亡率和发病率很高,每年导致约500万人死亡。脑缺血后立即脑细胞突然的停止氧气和营养供应,以及在许多情况下随后发生再灌注损伤,都会导致大量神经元死亡,这一般归因于ATP降低、兴奋性神经递质的释放、活性氧(ROS)的爆发、细胞内钙超载和局部炎症。这些病理学损伤也常常导致中风幸存者的后续残疾。因此,迫切需要神经元保护和再生疗法,然而保护中枢神经元免受中风后细胞死亡的有效方法目前尚不令人满意。
细胞外囊泡(EV)包括微囊泡、囊泡、外泌体、凋亡小体等,是高度异质的膜状囊泡,具有脂质双层和各种内容物,是参与细胞间通讯的新因子。EV根据不同标准进行分类,例如,外泌体或小囊泡(sEV)尺寸在30至150nm之间。外泌体通过神经酰胺或转运必需内吞体分选复合物(ESCRT)起源,并在多泡体融合后通过胞吐作用分泌到各种体液中。EV通过将其货物(包括蛋白质、核酸和脂质分子)传递到受体细胞中来发挥其功能。因此,在分泌到各种体液(包括血液、脑脊髓液、尿液、唾液和母乳)中后,EV通过受体细胞与配体相互作用的机制被受体细胞吸收。包括Flotillin-1(Flot-1)、caveolin(Cav)-1、Pak-1、Rac-1和Dynamin-2(Dyn-2)在内的一系列分子已被确定为介导EV /外泌体摄入的受体。通过内吞、吞噬或直接融合内化后,EV/外泌体能够将其货物递送到细胞质中,从而改变受体细胞的生理状态。
研究人员可以通过多种方法大规模制备EV,考虑到EV将生物活性分子输送到大脑中的优势,最近的研究集中于EV在包括中风在内的各种人类疾病中的治疗用途。例如,源自间充质干细胞(MSC)的功能化EV可以减少缺血性中风后大脑中缺血区域的体积。此外,在各种情况下,EV/外泌体也被证明可以调节中枢神经系统(CNS)中的脑血管生成、神经发生、神经元可塑性和神经胶质。内皮细胞(EC)构成中枢神经系统中最大的细胞群之一,并且紧邻神经元和神经干细胞(NSC)。ECs不仅在大脑中有血管新生作用,为神经细胞提供营养并带走代谢产物,还通过血管分泌生物活性分子来调节中枢神经系统中不同的细胞群。在中风时,EC和相关的血管分泌功能被证明参与了疾病的发作、发展和损伤后神经再生。近年来,EV尤其是EC分泌的外泌体的作用已被认为是介导EC-神经细胞相互作用的重要机制。研究人员此前研究表明,ECs衍生的外泌体可以促进小鼠的NSCs自我更新、增殖并抑制凋亡。然而,还没有充分探讨ECs衍生的EV在缺血和再灌注损伤(IRI)引起的神经元损伤中的作用和潜在机制。
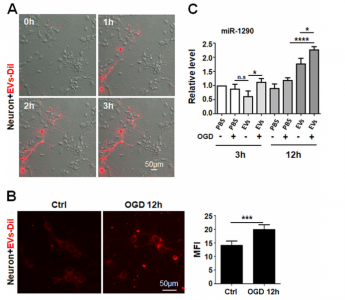
在这项研究中,研究人员检测了内皮细胞衍生的EV对缺氧-葡萄糖剥夺(OGD,模拟人类中风的神经元缺血再灌注损伤)后的神经元的影响。在人脐带内皮细胞(HUVEC)-神经元共培养测定中,研究发现HUVEC减少了OGD下神经元的凋亡,并且这种作用被外泌体释放抑制剂GW4869削弱。纯化的EV可被神经元内化并减轻OGD作用下的神经元凋亡。miRNA-1290在HUVEC衍生的EV中高度富集,并在OGD下负责EV介导的神经元保护。OGD可以增强体外培养的神经元对EV的摄入。对EV摄入受体的表达检测结果显示,在OGD处理的神经元和中脑动脉阻塞(MCAO)的小鼠中,caveolin-1(Cav-1)表达上调。抑制神经元中的Cav-1表达能够减少EV的摄入,并抑制了OGD下EV介导的神经元保护。HUVEC衍生的EV可减轻MCAO诱导的体内神经元凋亡。这些发现表明,缺血可能会上调神经元中Cav-1的表达,从而增加神经元对EV miRNA-1290的摄入,最终通过减缓凋亡来保护神经元。
图:OGD处理的神经元表现出HUVEC衍生EV摄取的增强
参考文献:Yue KY, Zhang PR, Zheng MH, Cao XL, Cao Y, Zhang YZ, Zhang YF, Wu HN, Lu ZH, Liang L, Jiang XF, Han H. Neurons can upregulate Cav-1 to increase intake of endothelial cells-derived extracellular vesicles that attenuate apoptosis via miR-1290. Cell Death Dis. 2019 Nov 18;10(12):869.