肿瘤相关的成纤维细胞通过改变原发性肿瘤微环境来促进癌症进展。来自大连医科大学刘婷姣课题组的研究人员在Molecular Cancer(IF=10.679)杂志上发表文章,阐明了在涎腺腺样囊性癌转移中肿瘤相关的成纤维细胞通过分泌细胞外囊泡与转移器官进行细胞间通讯的机制,并揭示了细胞外囊泡在肿瘤转移前生态位形成中的作用。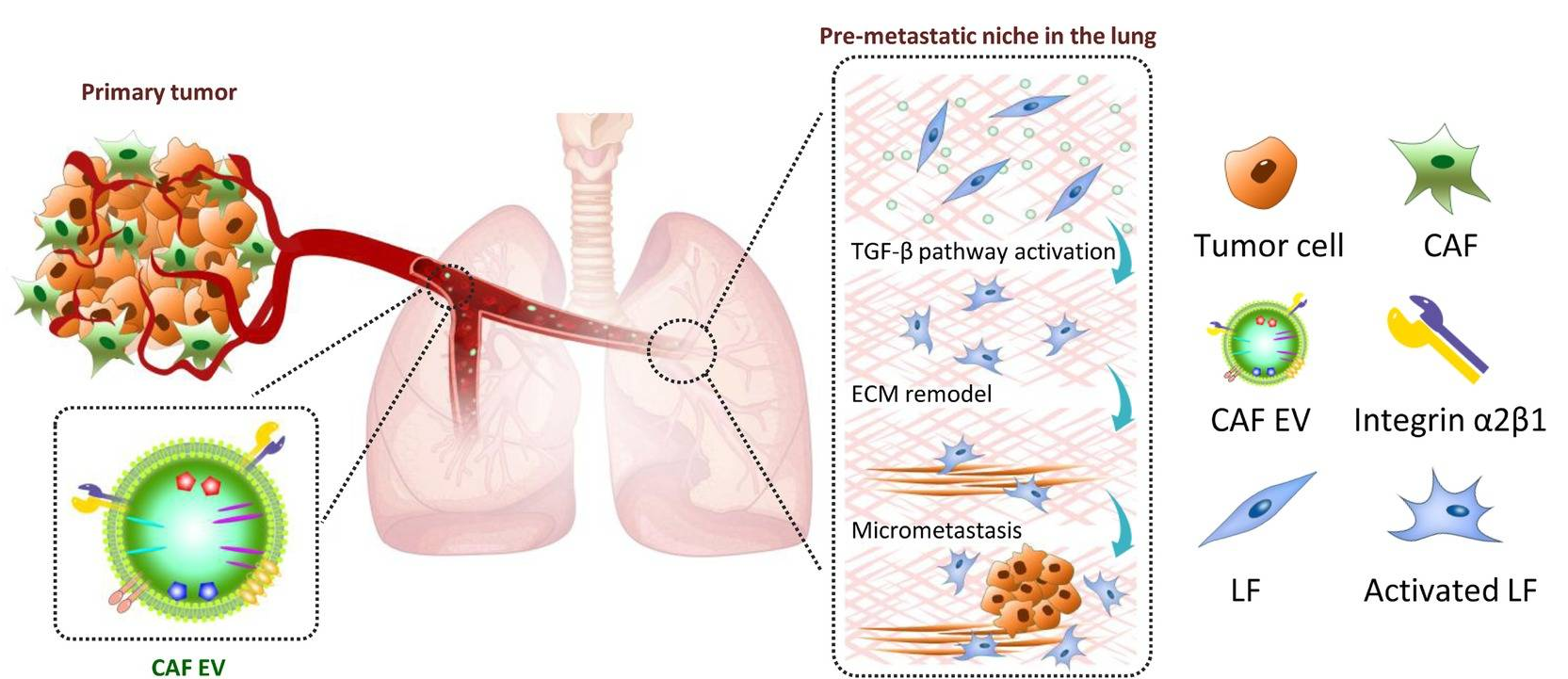
肿瘤相关的成纤维细胞(carcinoma-associated fibroblasts,CAF)被认为是肿瘤基质中的活化的成纤维细胞,并有助于恶性肿瘤的发生和发展。许多实验和临床研究支持CAF分泌生长因子、趋化因子、基质金属蛋白酶(MMP)和细胞外基质(ECM)来调节原发肿瘤中的肿瘤生长、血管生成和骨髓源性细胞(BMDC)募集,从而促进肿瘤转移。但是,CAF是否可以通过改变远处器官的微环境促进转移并不完全清楚。
已经有研究证明原发性肿瘤细胞能够通过在肿瘤细胞扩散之前就形成支持性和转移性的微环境(称为转移前的生态位)来影响和改变定植器官的微环境。转移前的生态位的形成是时空过程,有利于肿瘤细胞定植。在转移前生态位形成的初始阶段,肿瘤来源的一些因子通过血流转运增加靶器官的血管通透性。此外,这些因子受到促炎分子上调而被动员并募集BMDC到转移前部位。ECM重塑是转移前生态位形成过程中的关键步骤。纤连蛋白(FN)、MMP、赖氨酰氧化酶(LOX)和其他因素的沉积重塑了组织的微环境,以促进肿瘤细胞的粘附和定植。但是,关于CAF在转移前生态位形成中的作用的信息很少。
最近的发现表明,肿瘤衍生的产物可以通过细胞外囊泡(EV)传递到远处的器官。EV是细胞衍生的膜结构的异质性囊泡,包括小囊泡和大微泡。EV包含很多功能性分子,包括蛋白质、mRNA、miRNA、lncRNA和dsDNA。这些物质在传递过程中受到EV的保护,这对于远距离的各种器官之间的细胞通讯至关重要。EV不仅存在于生物体液中,而且也与基质结合作为ECM生物支架的组成部分和功能成分。肿瘤细胞来源的EV已被证明可以向肺、肝脏、和骨髓中输送蛋白质、mRNA和miRNA来参与转移前生态位的形成。
在这项研究中,研究人员旨在阐明CAF分泌的EV在肺转移前生态位形成中的作用。涎腺腺样囊性癌(SACC)是唾液腺最常见的癌症类型之一,容易在早期发生转移,而肺是最常见的转移部位,占所有转移的74.5%。因此,SACC是研究肺转移的理想肿瘤模型。研究人员比较了SACC分泌的EV和CAF分泌的EV在转移前生态位形成中的作用。研究人员使用CAF和SACC细胞分泌的EV建立了SACC的转移前和转移动物模型。用EV处理肺成纤维细胞(LFs),并通过RNA测序鉴定其转录组改变,同时提供ITRAQ分析EV货物成分。TC I-15作为整联蛋白α2β1的抑制剂,用于体内抑制LF吸收EV和SACC肺转移。结果显示,CAF EVs在小鼠中诱导了肺转移前的生态位形成,增强了SACC肺转移。CAF EV诱发的转移前生态位不同于SACC EV诱发的转移前生态位。CAF EV具有强大的基质重塑能力,骨膜素是CAF EV诱导的转移前生态位的潜在生物标记物。由CAF EV促进的肺成纤维细胞活化是转移前生态位的关键步骤。整联蛋白α2β1介导肺成纤维细胞摄取CAF EV,并被TC I-15阻断,从而阻止了肺转移前的生态位形成和随后的转移。携带异种移植肿瘤且肺转移的小鼠血浆EV整联蛋白α2β1明显上调。
该研究证明了CAF EV参与了肺转移前的生态位形成,并且血浆EV的整联蛋白可能是早期预测SACC转移的有前途的生物标志物。因此,针对肿瘤和基质细胞的综合策略对于预防SACC转移是很有必要的。
参考文献:Kong J, Tian H, Zhang F, Zhang Z, Li J, Liu X, Li X, Liu J, Li X, Jin D, Yang X, Sun B, Guo T, Luo Y, Lu Y, Lin B, Liu T. Extracellular vesicles of carcinoma-associated fibroblasts creates a pre-metastatic niche in the lung through activating fibroblasts. Mol Cancer. 2019;18(1):175.




