外泌体介导的lncRNA AFAP1-AS1通过与AUF1结合并激活ERBB2翻译来促进肿瘤细胞对曲妥珠单抗的耐药性
曲妥珠单抗是用于治疗HER-2阳性乳腺癌的主要药物之一,但是随着药物的使用,患者会出现耐药性问题,目前我们对其背后的耐药机制理解还不完善,有待进一步研究。近期,郑州大学附属第一医院韩明利博士、谷元廷教授和海南省人民医院董华英主任医师合作在Molecular Cancer发表研究文章介绍了肿瘤细胞通过外泌体携带的lncRNA AFAP1-AS1 在细胞间传递耐药性的发现。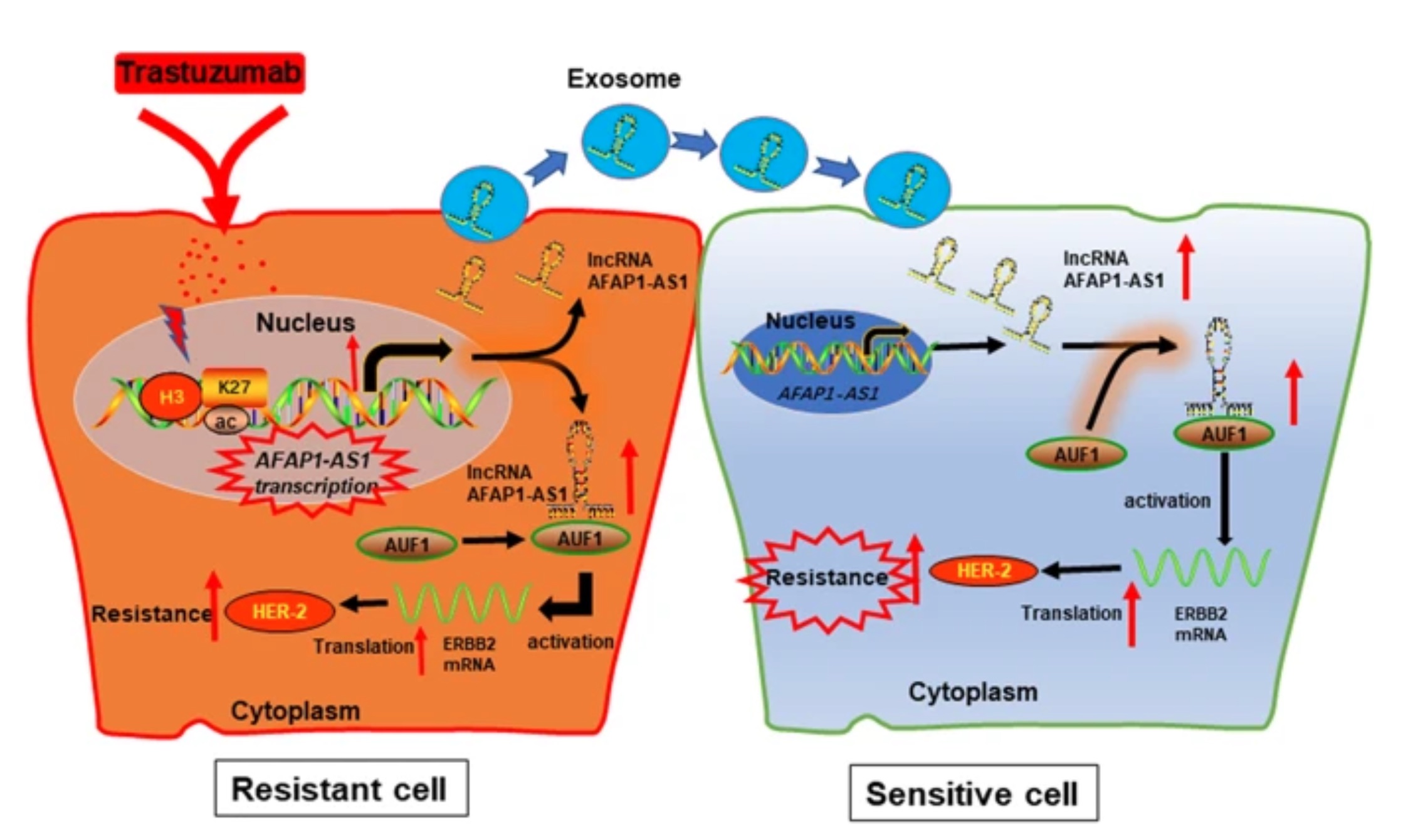
乳腺癌目前是世界上女性中与癌症相关死亡的首要原因,同时也是女性中发病率最高的癌症类型。在乳腺癌患者中,约20%的患者表现出HER-2基因的过表达,并且因此预后不良。目前,曲妥珠单抗(一种靶向HER-2细胞外区域的人源化单克隆抗体)已成为治疗HER-2阳性乳腺癌的一种重要策略。但是,对于转移性的HER-2阳性乳腺癌患者,只有一小部分患者对曲妥珠单抗治疗有响应,约60%的患者在最初反应后会产生耐药性。
长链非编码RNA(lncRNA)构成了一大类mRNA样转录物,它们的长度通常200个核苷酸,但是没有蛋白质编码能力。现有的研究表明,它们参与了各种各样的生物学过程,有报道通过转录水平到转录后水平等机制将lncRNA的失调与癌细胞的侵袭,增殖和转移联系起来。最近,各种研究报告,lncRNA是乳腺癌曲妥珠单抗耐药性的关键调节因子。有研究表明,lncRNA GAS5能够抑制乳腺癌的曲妥珠单抗耐药性,lncRNA UCA1可以作为”miRNA海绵”抑制miR-18a而诱导曲妥珠单抗耐药。 lncRNA ATB在乳腺癌曲妥珠单抗中也发挥着关键作用。这些研究表明lncRNAs在曲妥珠单抗耐药性的形成中可能是重要的调节子,但是,其详细功能和涉及的调节途径尚不完善。
外泌体是源自细胞膜系统的囊泡,起源于内体多囊泡体,释放到组织液中。这些囊泡含有蛋白质,脂质,源自其供体细胞质的编码或非编码RNA,并可以被其他细胞吸收。外泌体为特定的治疗剂提供了相对稳定的环境,具有被修饰以改善细胞特异性靶向能力的潜力,并具有与细胞质膜融合的能力,从而使治疗药剂可以直接进入细胞。以前,作者鉴定了一系列lncRNA(例如SNHG14和TINCR),它们在乳腺癌的曲妥珠单抗耐药中起重要作用。但是,lncRNAs是否可以通过包装到外泌体中扩散到敏感细胞并引起乳腺癌曲妥珠单抗耐药,目前我们还不清楚。
在这项研究中,作者通过使用已建立的曲妥珠单抗耐药细胞进行了基于微阵列的曲妥珠单抗耐药乳腺癌的基因表达谱分析。作者发现位于染色体4p16.1中的6.8-kb lncRNA 肌动蛋白丝相关蛋白1反义RNA 1(AFAP1-AS1)表达失调,并与曲妥珠单抗治疗耐药相关。此外,作者通过一系列的实验证明了 外泌体中AFAP1-AS1在曲妥珠单抗中的重要作用。在机制方面,实验结果表明,AFAP1-AS1可以与AU结合因子1(AUF1)蛋白结合,从而增强ERBB2基因的翻译。
肿瘤耐药性问题是影响肿瘤治疗效果的重要因素,本研究中外泌体携带的lncRNA AFAP1-AS1在耐药性中的作用的阐明为我们未来解决耐药性问题提供了一定的理论基础。
外泌体资讯网 外泌体携带的lncRNA介导肿瘤细胞对曲妥珠单抗的耐药性




