|
|
细菌和真核细胞使用细胞外囊泡(EVs)作为载体传递调节性蛋白质、脂质和核酸到相邻的细胞。细胞外囊泡通常分为两类:(1)与多泡体(MVBs)形成相关通过胞吐途径产生的外泌体(exosomes)和(2)由细胞质膜出芽形成的胞外体(ectosomes)。两者都携带效应蛋白和核酸。细胞外囊泡的功能包括转移耐药性,生长调节,群体感应,免疫调节,发育调节和神经递质传递。此外,包括癌症、动脉粥样硬化、神经退行性疾病、以及病毒和寄生虫的感染等在内的疾病都与细胞外囊泡的产生有关 。细胞外囊泡的明确功能是在物种内和物种之间递送调节性分子到其他细胞。细胞外囊泡的功能差异反映在EV合成的机制不同和组成成分的不同。
动质体(Kinetoplastid)是一种附有鞭毛的原生动物,包含某些能使人类或其他动物发生严重疾病的寄生虫,如非洲昏睡病(布氏锥虫罗德西亚亚种和冈比亚布氏锥虫)、南美锥虫病(克氏锥虫)、黑热病(利什曼原虫)以及牛的那加那病(布氏锥虫布氏)。克氏锥虫和利什曼原虫释放与宿主细胞相互作用细胞外囊泡,调节免疫应答。其他真核生物病原体也可生产细胞外囊泡。恶性疟原虫感染的红细胞来源的细胞外囊泡促进寄生虫的分化并调节哺乳动物宿主中的免疫细胞。泌尿生殖道寄生虫阴道毛滴虫产生细胞外囊泡,改变与宿主细胞的粘附性并调节感染宿主的免疫反应。
人类和其他高等灵长类凭借循环中的锥虫裂解因子(TLF)对许多非洲锥虫具有先天性免疫作用。人类致病性罗德西亚布氏锥虫通过表达毒力因子血清抗性相关蛋白(SRA)来规避TLF活性。SRA的作用机制包括结合载脂蛋白L-1(APOL-1),该蛋白与TLF的作用发挥密切相关。TLF的结合、吸收及运输到罗德西亚布氏锥虫细胞内早期内涵体,导致SRA和TLF的共定位,有利于APOL-1活性被中和。布氏锥虫指名亚种转染SRA编码基因或采采蝇与布氏锥虫罗得西亚亚种合并感染将SRA编码基因转移到布氏锥虫布氏亚种并赋予其抗TLF的特性。这个毒性蛋白在锥虫之间直接转移尚未见报道。
像许多细胞外的病原体一样,非洲锥虫感染最初引起包括炎症细胞因子的表达和骨髓细胞的活化在内的Ⅰ型免疫应答。这些宿主的免疫反应可解释锥虫病相关的贫血的病理。急性感染期间贫血症状严重,并且是那加那病引起牛死亡的主要原因。近日,有研究证明活化的肝和脾髓样细胞是噬红细胞作用的主要贡献者。此外,红细胞的脂质成分在锥虫感染期间被改变并且这些红细胞由宿主的髓细胞优先吞噬。虽然宿主反应导致贫血已被鉴定,这引起红细胞清除的寄生虫因素仍然是未知的。
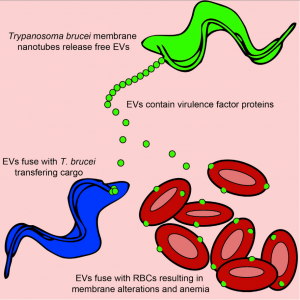
来自美国佐治亚大学的研究人员揭示了锥虫鞭毛膜出芽形成动态膜纳米管并形成细胞外囊泡。这些细胞外囊泡的蛋白质富含特定的鞭毛膜蛋白,并包含了一些与宿主体内的发挥毒力和抗性作用相关的蛋白质。在功能上,锥虫细胞外囊泡与包括相邻锥虫的鞭毛囊在内的靶细胞的脂质双层融合,导致脂质和蛋白质的的转移和内化。被转移的蛋白质仍然具有活性,罗得西亚锥虫细胞外囊泡转移SRA到布氏锥虫,使得后者具有TLF耐受性。布氏锥虫细胞外囊泡也与宿主血红细胞细胞膜高度融合,从而改变血红细胞细胞膜的物理性能并使红细胞从循环中清除。这种通过细胞外囊泡的交流作用会导致动物和人类感染非洲锥虫期间的贫血。该研究结果发现,细胞外囊泡导致了非洲锥虫病的复杂性,细胞外囊泡可在寄生虫之间和易被忽视的与宿主细胞之间传输毒力因子。这项研究工作揭示了非洲锥虫病的发病重要机制,为该疾病的治疗提供了新思路。
摘要:
寄生虫之间及其与宿主细胞之间的交流提供了寄生虫发育,免疫逃逸和疾病病理的机制。血流中的非洲锥虫由鞭毛膜产生膜纳米管并分解成游离的细胞外小泡(EVs)。锥虫细胞外囊泡包含几个有毒性的鞭毛蛋白,布氏锥虫罗德西亚亚种的细胞外囊泡包含血清耐药相关蛋白(SRA),此为人感染性所必需。布氏锥虫罗得西亚亚种的细胞外囊泡转移SRA到非人类传染性的锥虫,使其逃避人体先天免疫。锥虫细胞外囊泡还可以与哺乳动物的红细胞融合,造成红细胞被迅速清除,从而导致贫血。这些数据表明,锥虫细胞外囊泡是一种细胞器,可介导非遗传性毒力因子的转移,使宿主红细胞重构,从而导致贫血。
该研究亮点:
- 发现了布氏锥虫可由膜纳米管产生细胞外囊泡;
- 细胞外囊泡可在锥虫间传递血清耐药相关蛋白(SRA);
- 细胞外囊泡传递的SRA使锥虫对人体先天免疫产生抗性;
- 细胞外囊泡与红细胞融合传递脂质和蛋白质并导致贫血。
参考文献:Szempruch, A. J., et al. (2016). "Extracellular Vesicles from Trypanosoma brucei Mediate Virulence Factor Transfer and Cause Host Anemia." Cell 164(1-2): 246-257.
版权归外泌体资讯网所有,欢迎转载,但请注明出处和原文链接!




