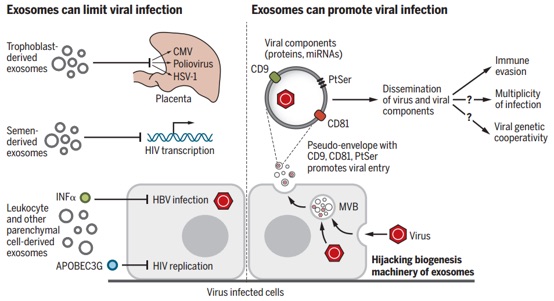
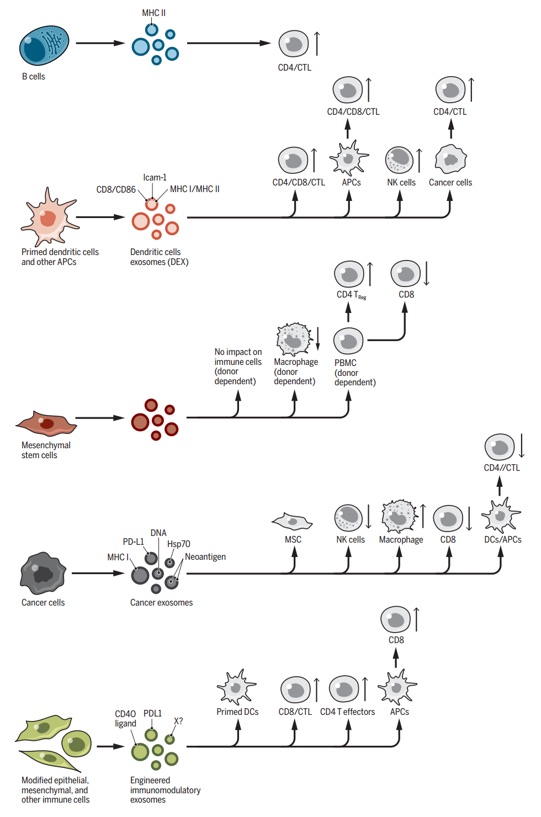
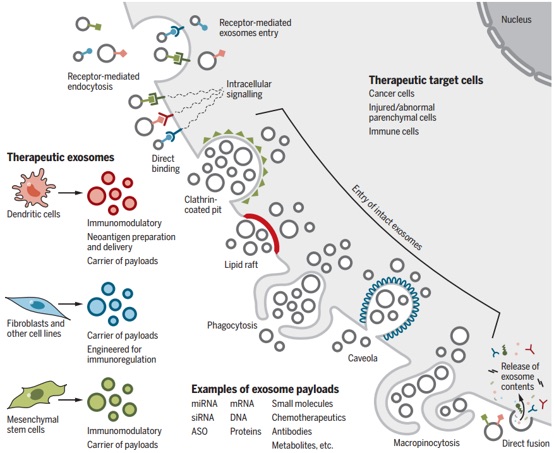
近日,外泌体领域大牛Raghu Kalluri教授在Science杂志(影响因子41.037)发表综述,概览了当前外泌体领域的主要研究发现、面临的挑战,并对其生物医学应用提出了展望。
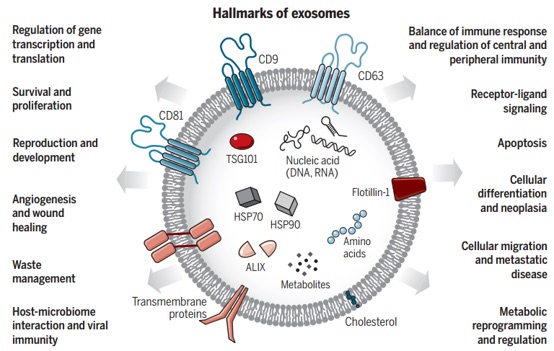
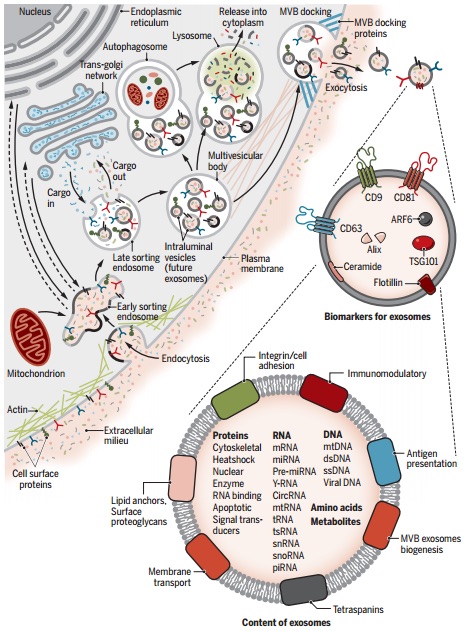
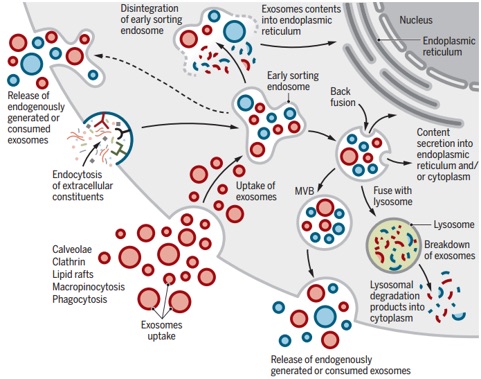
细胞外囊泡(EVs)的研究具有识别未知的细胞和分子机制的潜力,这些机制在细胞间通讯以及器官体内稳态和疾病中发挥着重要作用。外泌体是EV的一种,平均直径约100纳米。外泌体的生物发生涉及其起源的内体,随后与其它细胞内囊泡和细胞器的相互作用产生外泌体的最终内含物。它们的各种成分包括可以反映其起源细胞的核酸、蛋白质、脂质、氨基酸和代谢产物。在各种疾病中,外泌体提供了细胞或组织状态改变的新视角,它们在生物体液中的检测可能提供多组分诊断信息。基于外泌体的物质信息传递能力可以设计基于外泌体的疗法。
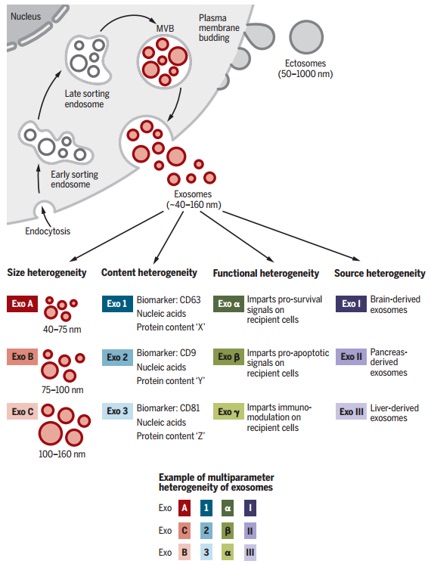
细胞外囊泡(EV)及其在多细胞生物中控制其生成和功能的机制的研究涉及从生理组织调节到致病性损伤和器官重塑的各个领域。EV作为各种疾病(包括神经退行性疾病、心血管功能障碍和癌症)的诊断和治疗工具的潜力激发了该领域的研究。EV的研究越来越多地针对EV的分类、分离方法、以及将其在疾病进展和治疗中的假定功能进行分类。EV生物学活动的当前表征在很大程度上依赖于培养物的产生,非生理学数据以及多种EV分离方法,需要进一步完善。因此,尚不清楚EV的某些特性在健康或疾病的整个生物中是否与生理相关。尽管如此,如最初报道的网织红细胞成熟中转铁蛋白受体,细胞产生的EV似乎超出了简单的蛋白质回收功能,并随细胞来源、代谢状态和细胞环境而变化。EV的研究仍然受到当前单颗粒检测和分离的实验限制,以及无法以可靠的分辨率在体内成像和跟踪外泌体的限制。尽管有这样的实验性问题,但仍出现了令人兴奋的发现。EV作为液体活检的实用性特别有前途,因为它们存在于所有生物流体中,并且具有进行多组分分析的潜力。
尽管EV的分类在不断发展,但它们通常分为两大类:ectosomes和exosomes。ectosomes是由质膜直接向外发芽产生的囊泡,其会产生直径约50 nm至1 mm的微囊泡(microvesicles)、微粒(microparticles)和大囊泡(large vesicles)。相比之下,exosomes是内体来源的,直径范围约为40至160 nm(平均约为100 nm)。这篇综述重点关注外泌体,并讨论其他EV,以在相关时提供对比和比较。至关重要的是,在建立用于研究外泌体的纯化和分析流程时,挑战仍然存在,我们得到的可能是包括外泌体的EV异质群体。因此,讨论的某些发现可能反映了外泌体与其他EV混合的结果。外泌体在生物学中特别受关注,因为它们的产生涉及一个独特的细胞内调节过程,一旦分泌到细胞外空间,就可能确定其组成,并可能决定其功能。重要的是要认识到外泌体分离方法正在不断发展,并且当前的生物学标记可能只能识别具有特定内含物的外泌体亚群。因此,随着新技术的采用,一些发现将需要完善。
这篇综述的主要内容包括:外泌体的生物发生、外泌体的异质性、细胞间通信、哺乳动物的繁殖和发育、免疫反应和感染、代谢和心血管疾病、神经退行性疾病、癌症、外泌体的临床应用(诊断和治疗)。
外泌体的研究是一个非常活跃的研究领域。持续的技术和实验进展可能会产生有关其异质性和生物学功能的有价值的信息,并增强我们利用其治疗和诊断疾病潜力的能力。随着我们开发更多标准化的纯化和分析程序来研究外泌体,这很可能揭示它们的功能异质性。尽管如此,使用富含外泌体的EV进行的功能性研究已经为它们对各种疾病的贡献提供了新的见解。具有在健康和疾病中de novo产生或诱导细胞特异性外泌体生成能力的新型遗传小鼠模型可能会揭示外泌体在局部和器官之间的细胞间通讯中的因果作用。外泌体的生成和内容物是否随年龄而变化需要研究,这些信息可以提供有关组织衰老、器官退化以及程序性或过早衰老的新见解。甚至有人推测EV和/或外泌体是否存在于地球上首次出现单细胞生物之前,并且未来进行的生物电和生化实验可能会揭示它们与细胞无关的生物学功能。单外泌体的鉴定和分离以及低温电子显微镜分析有可能极大地提高我们对外泌体的基本生物学及其在应用科学和技术中的应用的理解。这些知识将为您提供外泌体对各种疾病(包括癌症和神经退行性疾病)的治疗潜力。
参考文献:
Kalluri R, LeBleu VS. The biology, function, and biomedical applications of exosomes. Science. 2020 Feb 7;367(6478). pii: eaau6977. doi: 10.1126/science.aau6977. IF=41.037