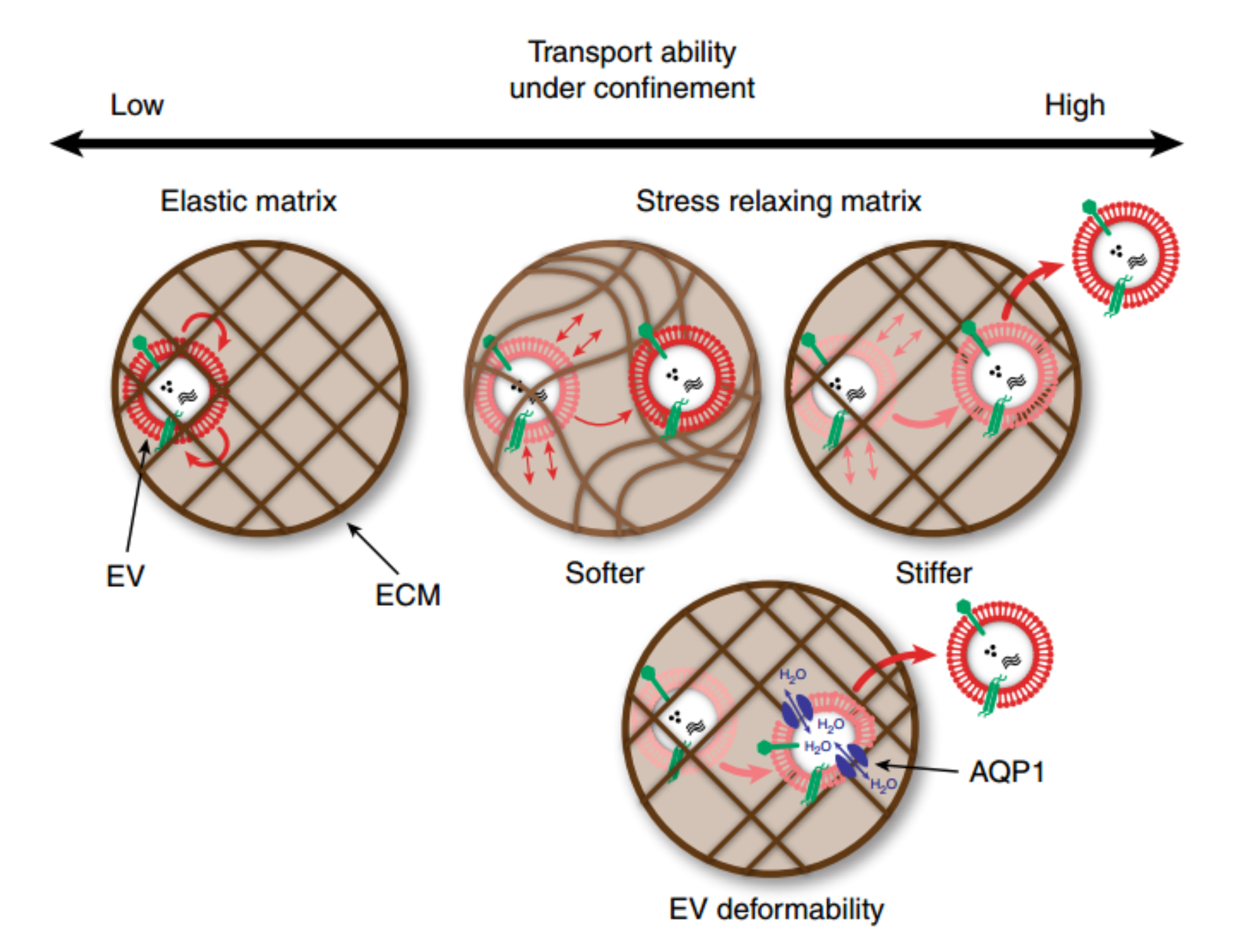
细胞释放细胞外囊泡(EVs)进行长距离通讯,这需要EV穿越细胞外基质(ECM)。但是,EVs的尺寸通常大于ECM的网格尺寸,因此尚不清楚它们如何穿过密集的ECM。最新一项发表在Nature Nanotechnology杂志(影响因子33.407)上的研究表明,与合成纳米颗粒相反,EVs易于通过纳米多孔ECM进行转运。使用工程水凝胶证明了在限制条件下基质的机械性能调节了异常EVs的运输。基质应力松弛使EVs能够克服局限性,而更高的交联密度则有利于通过聚合物网状物的波动运输运动,从而导致自由扩散和快速运输。此外,水通过Aquaporin-1的渗透介导了EV的可变形性,从而进一步支持了EV在水凝胶和脱细胞基质中的转运。研究结果证明了EVs在密闭环境中运输的性质,并证明了其对基质力学和水渗透性的依赖。

近些年,细胞外囊泡(EV)引起了极大的关注,不仅是由于其基本生物学特性,而且还因为它们在治疗中的应用潜力。EVs是在体外和体内几乎所有细胞类型都能释放的纳米颗粒。它们由结合了几种不同表面和膜蛋白的磷脂双层组成。此外,EVs可以载运包括miRNA、蛋白质或抗性基因在内的货物。EVs可以选择性地和特异性地在供体细胞和受体细胞之间以及近距离和远处转移其生物学信息。EVs保护和传递信息的能力激发了人们对了解基本细胞通讯机制并将其用于治疗应用的研究兴趣。尽管尚未完全了解EV靶向和进入靶细胞的机制,但已有文献提供了这些天然载体可用于递送化合物以治疗各种疾病的潜在证据。
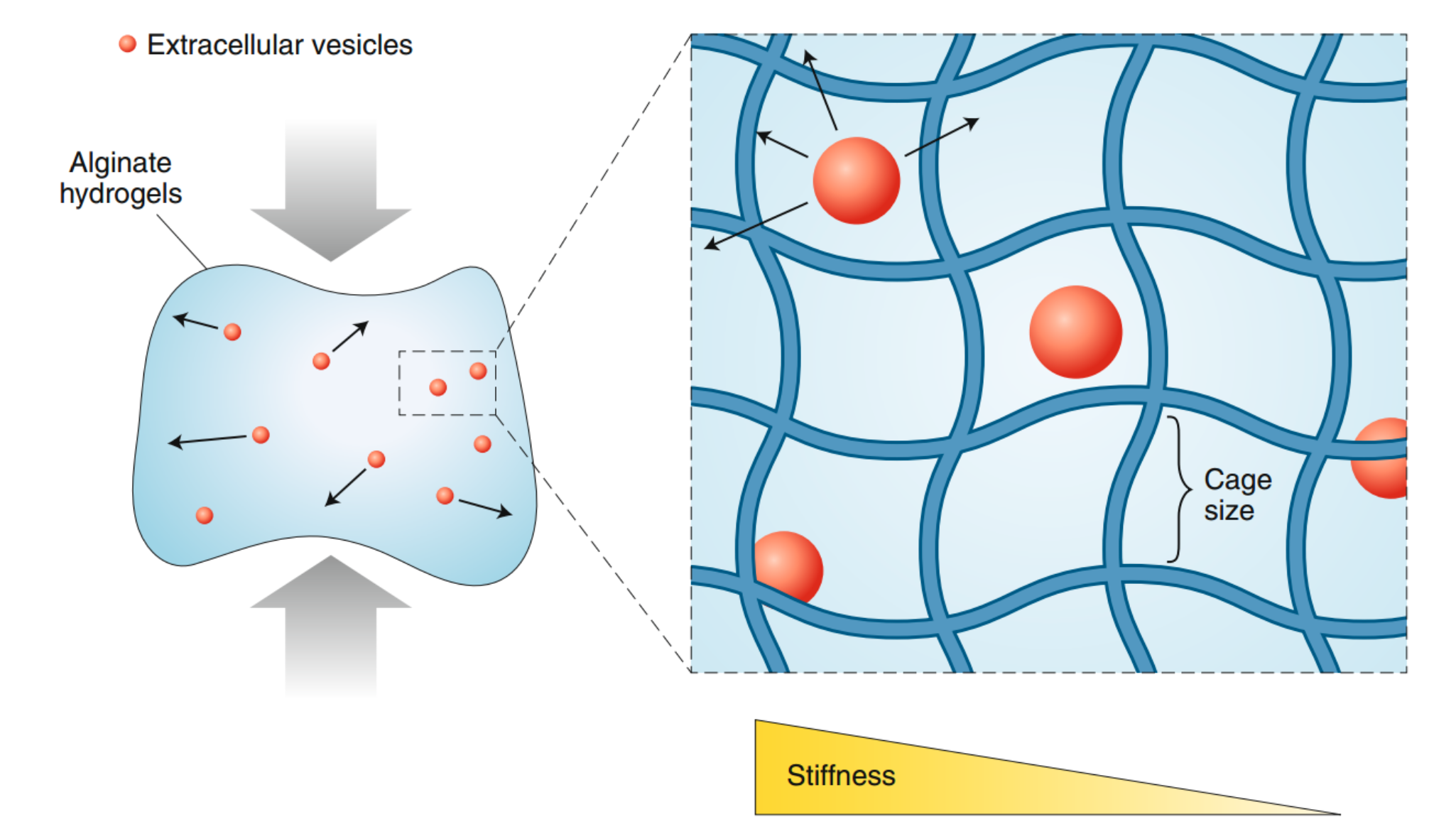
有趣的是,EV表征通常主要集中在大小和数量、特定表面蛋白和核酸成分的检测上。实际上,对EVs的机械性能的作用以及运输机制与复杂细胞环境相互作用的影响的研究很少。来自美国伊利诺伊大学芝加哥分校的Jae-Won Shin教授研究组最新在Nature Nanotechnology杂志(影响因子33.407)上发表文章,使用水凝胶模型揭示了EVs在细胞外基质(ECM)中的扩散和运输过程。作者假设,为了避免ECM积累(这可能会限制EV到达其靶细胞的效率),存在着依赖于基质的囊泡清除和转运机制。使用间充质干细胞(MSC)衍生的EVs和藻酸盐水凝胶,与其他纳米载体相比,研究了EVs在密闭环境中的运输。之所以选择MSC EV,是因为它们可以充当低免疫原性的药物载体,并且它们通常存在于间隙基质区域中。海藻酸盐代表了不可降解水凝胶的简单且可广泛应用的模型,其模拟了脱细胞ECM的机械性能。
在藻酸盐凝胶的初步筛选中,研究人员观察到,在孵育24小时内释放了小的葡聚糖分子,而较大的聚苯乙烯珠被困在了水凝胶基质中。相比之下,尽管具有相似的粒径,EVs仍能够逃脱应力松弛水凝胶,优于人工聚苯乙烯珠。有趣的是,相同大小的磷脂载体(例如脂质体)的释放程度没有比EVs高,这表明这种作用是囊泡特异性的,并依赖于基质的机械性能。因此假设仅脂质膜的存在不足以增强EV转运,表面蛋白也可能参与该现象。
为了更好地理解水凝胶中EV释放的机械敏感性,研究人员采用带反褶积的高速三维(3D)显微镜对不同条件下随时间变化的EV传输进行可视化和量化。这种3D方法与EVs在矩阵内自由运输所需克服的特定笼形尺寸的计算相结合。这些“笼子”可以看作是水凝胶中的腔体,它们显示出确定的大小,被包裹的颗粒必须穿过这些腔体才能通过基质。有趣的是,刚性应力松弛矩阵中的EV比软应力松弛矩阵中的EV更快地逃离了“笼子”。此外,坚硬的弹性模量可防止EVs逃离水凝胶笼,这凸显了这样一个事实,即基质应力松弛是EVs从受限基质中逸出的关键因素。
限制条件下的EVs运输模型
最后,研究了水通道蛋白对EV膜的影响。研究人员猜测,通过这些通道的水通量可能会影响EVs的机械性能。确实,EVs需要功能性水通道蛋白来渗透水,这反过来会使EVs变形。抑制MSC中水通道蛋白导致了EV的产生,这表明从水凝胶中释放的减少。EV的冻干(可能会影响膜的完整性和水通道蛋白的功能)也导致水凝胶中EV的运输损失,这表明水渗透对于ECM中的EV变形和导航具有重要作用。
该研究工作为我们对基本EVs通信过程和EVs在生物基质中的生理作用的理解提供了重要信息,因此,这是该领域的重大进步。EVs在复杂环境中的机械性能也与其作为药物载体的应用有关,例如,以了解全身给药后血液循环在剪切应力下的EVs性能。的确,对于脂质体,已有研究表明机械性能是细胞相互作用期间的重要因素,并且纳米颗粒的弹性会影响其在癌细胞中的摄取。在EVs领域,对其机械模量的研究仍然不够。对于源自红细胞的EVs,膜流动性受患者疾病状态的影响,这可能是设计新诊断方法的工具信息。此外,这项工作中提出的结果也提示外源整合水通道对人工脂质体行为的影响。调节这些磷脂载体的可变形性可能有助于它们的组织分布和递送效率。
水凝胶模型中细胞外囊泡的转运机制
参考文献:
Lenzini, S., Bargi, R., Chung, G. et al. Matrix mechanics and water permeation regulate extracellular vesicle transport. Nat. Nanotechnol. (2020). DOI: 10.1038/s41565-020-0636-2
Fuhrmann, G. Diffusion and transport of extracellular vesicles. Nat. Nanotechnol. (2020). DOI: 10.1038/s41565-020-0651-3




