1月11日,来自哈佛医学院的研究人员在国际著名期刊Nature materials(IF=36.5)在线发表了最新研究成果“Genesis and growth of extracellular-vesicle-derived microcalcification in atherosclerotic plaques”该研究揭示了细胞外膜泡介导动脉粥样硬化斑块中微钙化发生发展的机制。
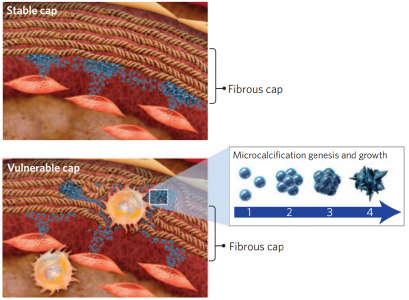
临床证据显示动脉钙化(何为钙化,请看下文说明)与心血管疾病有相关性。动脉粥样硬化斑块内的应力分布的有限元建模分析显示,纤维帽(纤维帽是什么,请看下文说明)的亚细胞微钙化可促进斑块的材料失效,但大的钙化可以稳定它。然而,动脉粥样硬化过程中矿物形成和生长的物理化学机制尚不清楚。来自哈佛医学院的研究人员通过使用三维胶原凝胶,模仿动脉粥样硬化的纤维帽的结构特征,用高分辨率显微和光谱分析水凝胶和人的钙化斑块,结果表明,钙化矿物形成和成熟与钙化细胞外囊泡的聚集,微钙化的形成和最终大钙化等一系列的事件有关。钙化形态和斑块的胶原蛋白含量两因素与动脉粥样硬化斑块的稳定性是相互关联的。

什么是血管钙化
血管钙化是异位钙化一种,分为中膜钙化和内膜钙化,中膜钙化相关的疾病有肾病、糖尿病等,而内膜钙化主要与动脉粥样硬化有关。动脉钙化是粥样硬化的特征性病变之一,动脉粥样硬化钙化病变的程度直接与粥样硬化疾病的斑块负荷及血管事件发生率有关,是心血管事件的危险标志。因此,研究动脉粥样硬化钙化病变对动脉粥样硬化的防治具有重要意义。
动脉粥样硬化钙化的形成机制
动脉粥样硬化钙化(atherosclerotic calcification, AC)是动脉粥样硬化斑块发展到一定程度,钙盐在斑块中沉积而形成的。目前人们对动脉粥样硬化钙化的形成机制尚不清楚。Bobryshev运用电镜和免疫组织化学方法研究人和载脂蛋白E (Apo E)基因敲除鼠斑块的细胞类型时发现坏死的脂质核周围出现类软骨样细胞(chondrocyte-like cells),且这些区域中,一些平滑肌细胞表现出了软骨样细胞的特征,当软骨样细胞裂解后,细胞间隙出现许多羟磷灰石结晶的小囊泡,推测可能是平滑肌细胞分化为软骨样细胞,最终导致AC。观察体外血管平滑肌细胞钙化模型可发现斑块的钙化主要是由平滑肌细胞表型的改变造成。Tada Y等的研究也发现,过度氧化应激和血管平滑肌细胞向成骨细胞转化参与了糖基化终末产物介导的血管钙化过程。
随着分子生物学和免疫组化等技术的发展,发现粥样硬化动脉的钙化是一个与新骨形成极为相似的受基因调控的主动性代谢过程,在这一过程中有多种功能复杂的糖蛋白、mRNA、谷氨酸羟基酶等参与,这些糖蛋白主要是与新骨生成和钙化有关的蛋白,如骨桥素、骨连接素、骨钙素以及骨形成蛋白-2a等,因此目前认为动脉粥样硬化钙化是一个有组织、有调控的主动性过程,其钙盐的主要成分是羟磷灰钙,而不是原来认为的磷酸钙,此过程需要基因调控并通过以下基因/蛋白包括基质GLA蛋白和骨保护蛋白、端粒、碱性磷酸酶、Ⅰ型胶原和BMP-2。40-50%主动脉及冠状动脉钙化的发生与基因有关。既往对相关基因的研究已证实,一些基因位点与冠状动脉钙化相关,而其中部分基因位点与也与动脉粥样硬化相关。例如9p21位点与血管疾病广泛相关,同时与亚临床动脉粥样硬化及钙化相关。最近一项关于冠状动脉钙化和心肌梗死的META分析显示,对来自5个同年龄组的1000名受试者定位了在9p21位点临近细胞周期蛋白基因、CDKN2B和CDKN2AA处的48种单核苷酸多态性,其与冠状动脉钙化的发生密切相关。这些基因编码的细胞周期蛋白可能与细胞衰老及炎症广泛相关。这种基因定位尚不清楚,因为它是一个固有的基因缺乏区,故起始DNA序列仍存在争议。因此,动脉粥样硬化钙化的机制需要更深入的研究。
纤维帽是什么
动脉粥样硬化斑块由纤维帽和脂质核组成,纤维帽作为脂质核与血液的分隔屏障,是影响斑块稳定性的重要因素。任何降低斑块纤维帽厚度或改变其基质成分(或比例)使其抗血流机械强度减弱的因素都可增加斑块的不稳定性,因此评价斑块纤维帽厚度及结构特征对于评价斑块稳定性有重要意义。
动脉粥样硬化钙化与斑块稳定性的关系
动脉钙化是粥样硬化的特征性病变之一。动脉粥样硬化临床重要事件是血栓的形成,易损斑块破裂是导致这一事件发生的重要机制。与完全钙化的斑块不同,斑块内接近纤维帽或者通过纤维帽向管腔突出的钙化结节是易损斑块的特征之一,美国心脏协会也将斑块表面结节钙化作为判断易损斑块的次要标准。目前认为,在钙化尚未形成融合状态时,斑块肩部即不同密度组织的交界面由于受压而易破裂,钙化融合后,这种交界面减少,破裂发生率随之降低。而 Huang等认为钙化可能不会影响冠脉粥样硬化斑块的机械稳定性,他们对20例冠心病患者的冠状动脉斑块的研究发现,在破裂的或稳定的冠脉粥样硬化斑块,脂质核显著地增加纤维帽的应力,而钙化对纤维帽应力的影响并不明确。因此,目前对于钙化本身是否会影响斑块的稳定性或增加斑块破裂的风险这一问题尚存在争议。
参考文献:
Hutcheson, J. D., et al. (2016). "Genesis and growth of extracellular-vesicle-derived microcalcification in atherosclerotic plaques." Nat Mater. IF=36.5
Clinical evidence links arterial calcification and cardiovascular risk. Finite-element modelling of the stress distribution within atherosclerotic plaques has suggested that subcellular microcalcifications in the fibrous cap may promote material failure of the plaque, but that large calcifications can stabilize it. Yet the physicochemical mechanisms underlying such mineral formation and growth in atheromata remain unknown. Here, by using three-dimensional collagen hydrogels that mimic structural features of the atherosclerotic fibrous cap, and high-resolution microscopic and spectroscopic analyses of both the hydrogels and of calcified human plaques, we demonstrate that calcific mineral formation and maturation results from a series of events involving the aggregation of calcifying extracellular vesicles, and the formation of microcalcifications and ultimately large calcification areas. We also show that calcification morphology and the plaque's collagen content-two determinants of atherosclerotic plaque stability-are interlinked.
版权归外泌体资讯网所有,欢迎转载,但请注明出处和原文链接!




