来自病毒载体的CRISPR-Cas9核酸酶和gRNA的长时表达可能导致脱靶和免疫原性。因此,治疗的基因组编辑应用需要瞬时递送系统。来自日本京都大学的Akitsu Hotta研究组通过利用两种不同的归巢机制,开发了一种基于细胞外纳米囊泡的核糖核蛋白递送系统,名为NanoMEDIC。化学诱导的二聚化将Cas9蛋白募集到细胞外的纳米囊泡中,然后产生病毒RNA包装信号和两个自切割核糖开关链,并将sgRNA释放到纳米囊泡中。该研究展示了在各种难以转染的细胞类型中的有效基因组编辑,包括人类诱导多能干细胞(iPS)、神经元和成肌细胞。NanoMEDIC还可以在源自Duchenne肌营养不良(DMD)患者iPS细胞的骨骼肌细胞中实现超过90%的外显子跳跃效率。最后,单次肌内注射NanoMEDIC会在萤光素酶报告基因小鼠和mdx小鼠中诱导永久性的基因组外显子跳跃,表明其可用于DMD及其它疾病的体内基因组编辑治疗。
成簇的规律间隔的短回文重复序列(CRISPR)相关蛋白(Cas9)能够有效编辑培养中的人类细胞,并具有作为治疗人类疾病的治疗工具的潜力。然而,需要CRISPR-Cas9的体内递送来靶向感兴趣的组织。Duchenne肌营养不良症(DMD)是一种严重的肌肉变性疾病,由X连锁基因抗肌萎缩蛋白(dystrophin)突变引起。骨骼肌和心肌细胞中缺乏抗肌萎缩蛋白,会导致肌肉稳定性下降并导致肌肉消瘦。据报道,CRISPR-Cas9是诱导iPSCs和体内动物DMD模型恢复抗肌萎缩蛋白表达的外显子跳跃的有效工具。腺相关病毒(AAV)已经成为体内基因传递的主要工具,并通过传递CRISPR-Cas9系统用于治疗DMD动物模型。然而,关于其在治疗中的潜在用途,存在一些局限性和担忧,包括有限的病毒基因组DNA包装能力(<5kb),抗AAV衣壳的中和抗体以及对Cas9蛋白的免疫原性。此外,可以观察到AAV转基因的长时间表达。对于SpCas9表达,这不是理想的,因为它可能会导致不需要的脱靶诱变。确实,最近的报告表明,用递送SaCas9的AAV载体处理的小鼠显示出免疫原性,并且将AAV载体DNA片段整合到宿主基因组中。为了使这些不利影响最小化,需要一种瞬时递送方法。CRISPR-Cas9的核糖核蛋白(RNP)递送优于DNA递送。它与DNA质粒表达载体相比,在培养细胞中RNP迅速降解,因此有助于有效的靶上剪切,同时还减少了不必要的脱靶效应。但是,将CRISPR RNP复合物递送到难以转导的组织中需要合适的递送系统,该系统需要有效地包装、保护感兴趣的货物并将其运送到目标组织中。病毒是蛋白质和核酸的天然载体,可传递到细胞中。通过表达病毒包膜和/或结构蛋白而产生的,缺乏病毒核酸基因组的细胞外囊泡(EV)可以用于蛋白质和RNA传递载体,并已在疫苗接种领域用于临床试验。逆转录病毒的结构多蛋白Gag是经过充分研究的,是将货物包装到EV中的理想选择,并且可以诱导EV从细胞中主动释放,据估计,每个病毒颗粒最多包含5000个Gag分子。以前,该研究团队和其他人已经将HIV和MLV Gag与感兴趣的蛋白质融合在一起,以传递到细胞中。尽管已有研究报道了EV介导的CRISPR-Cas9 RNP递送方法,例如将SpCas9与逆转录病毒Gag融合的Cas9P LV和NanoBlades系统、被动掺入SpCas9的VEsiCas系统或使用基于二聚化掺入SpCas9的Gesicle系统,但其在体内肌肉组织的适用性尚未阐明。此外,SpCas9与Gag的直接融合需要补充野生型Gag-Pol,以通过蛋白酶介导的裂解从Gag中释放Cas9,不然这会在EV中竞争空间并减少包装的SpCas9分子的数量。Pol中包含蛋白酶也有在靶蛋白隐蔽位点蛋白酶介导降解的风险,从而会减少递送的功能蛋白的数量。因此,需要Cas9蛋白和sgRNA的主动掺入机制,其不涉及Cas9蛋白与Gag的直接融合。总之,该研究开发了一种称为NanoMEDIC(nanomembrane-derived extracellular vesicles for the delivery of macromolecular cargo)的多合一EV递送系统。NanoMEDIC可有效诱导各种人类细胞类型的基因组编辑,例如T细胞、单核细胞、iPSC、iPSC衍生的皮质神经元和成肌细胞。NanoMEDIC也可以多路复用,以同时靶向DMD患者iPSC的剪接受体(SA)和供体位点(SD)以及转基因荧光素酶报道基因小鼠中。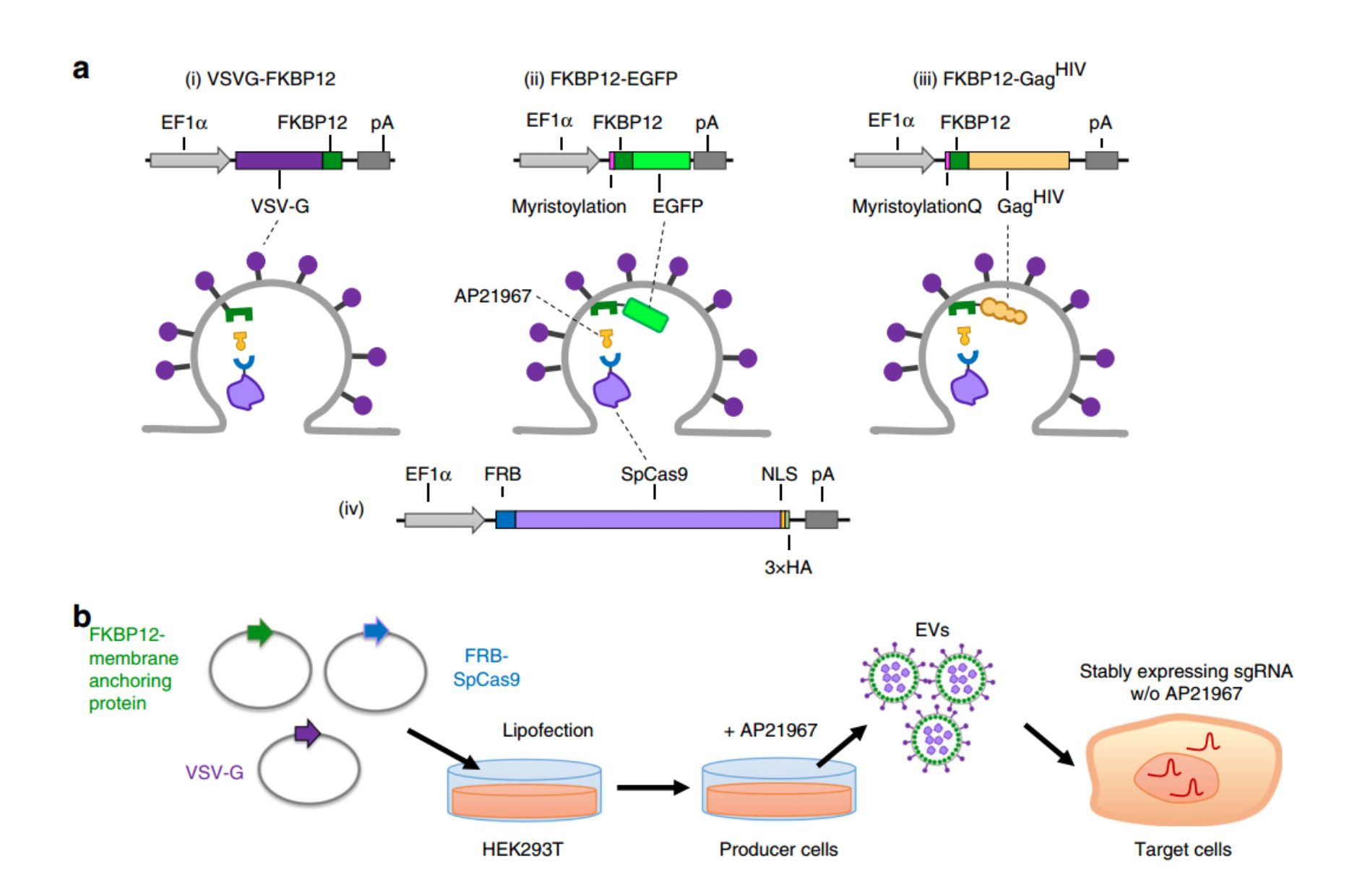
a 与FKBP12和FRB-SpCas9融合的膜锚定结构的示意图。b 从细胞产生NanoMEDIC并传递到受体细胞中的示意图。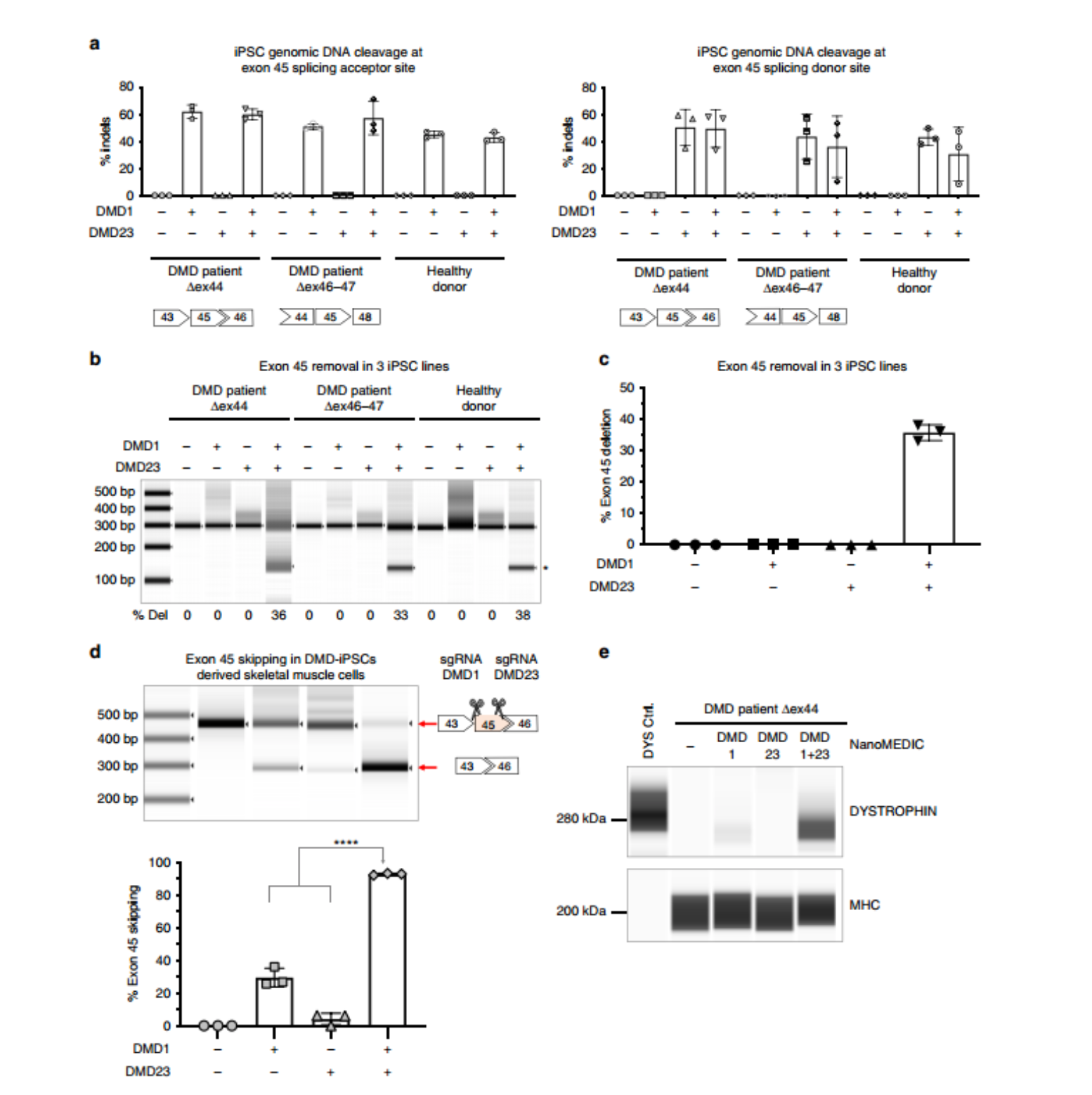
NanoMEDIC在DMD患者iPSC中诱导高效的基因组编辑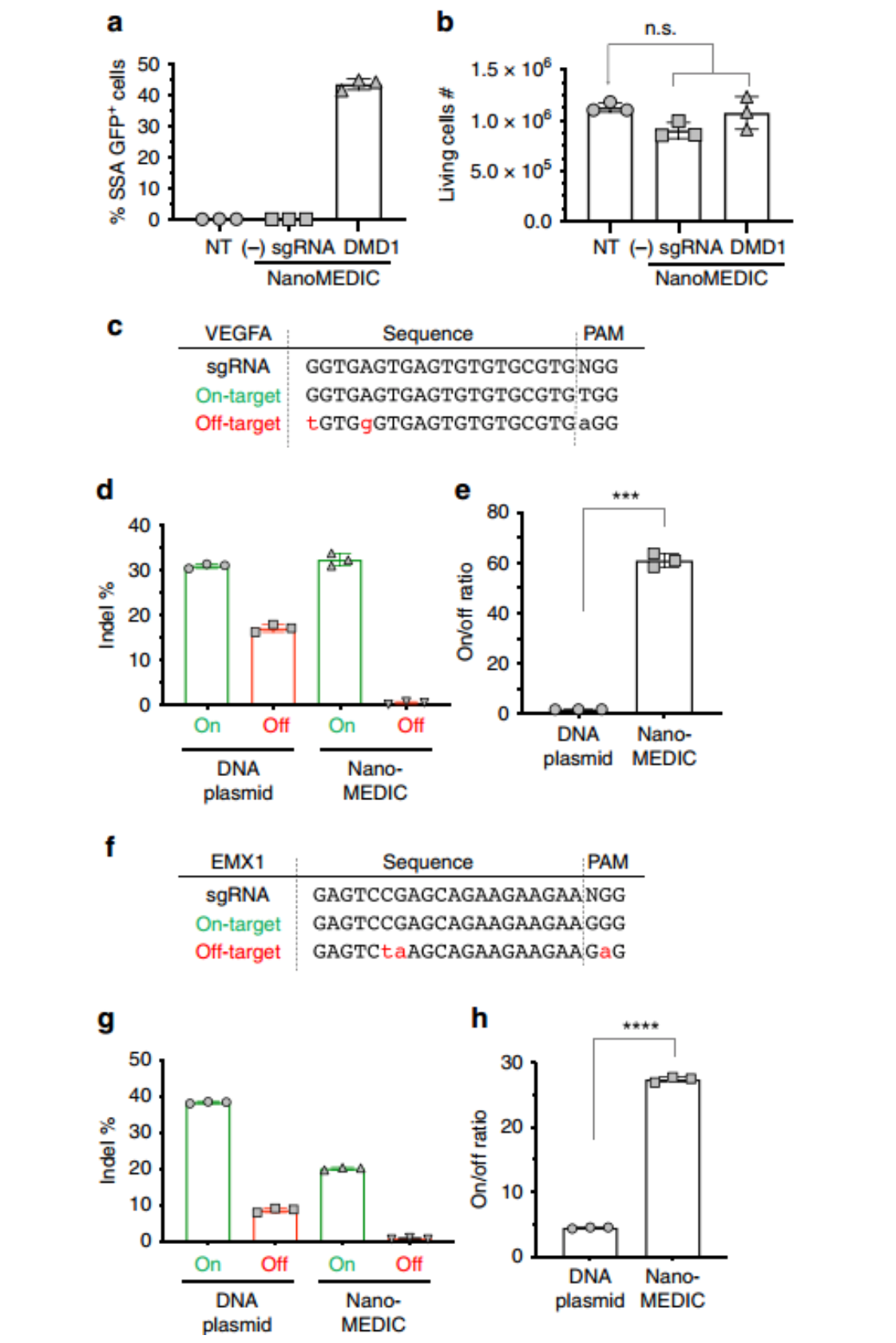
与质粒DNA转染相比,NanoMEDIC介导的基因编辑无毒并降低脱靶活性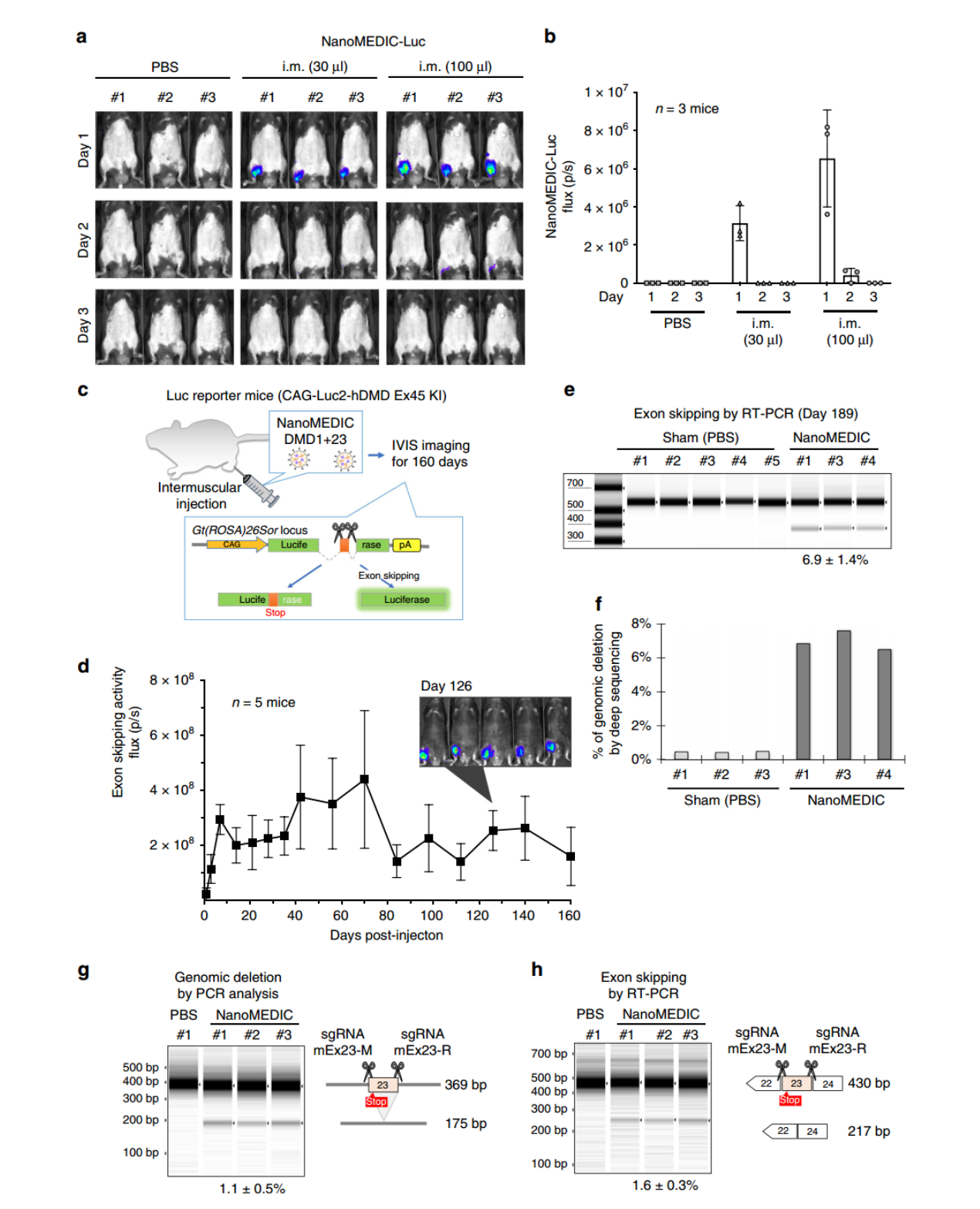
NanoMEDIC的瞬时肌肉内递送可在小鼠模型中诱导持续的基因组外显子跳跃参考文献:Gee, P., Lung, M.S.Y., Okuzaki, Y. et al. Extracellular nanovesicles for packaging of CRISPR-Cas9 protein and sgRNA to induce therapeutic exon skipping. Nature Communications 11, 1334 (2020). DOI: 10.1038/s41467-020-14957-y外泌体资讯网 Nature子刊:EV用于包装CRISPR-Cas9蛋白和sgRNA以诱导治疗性外显子跳跃