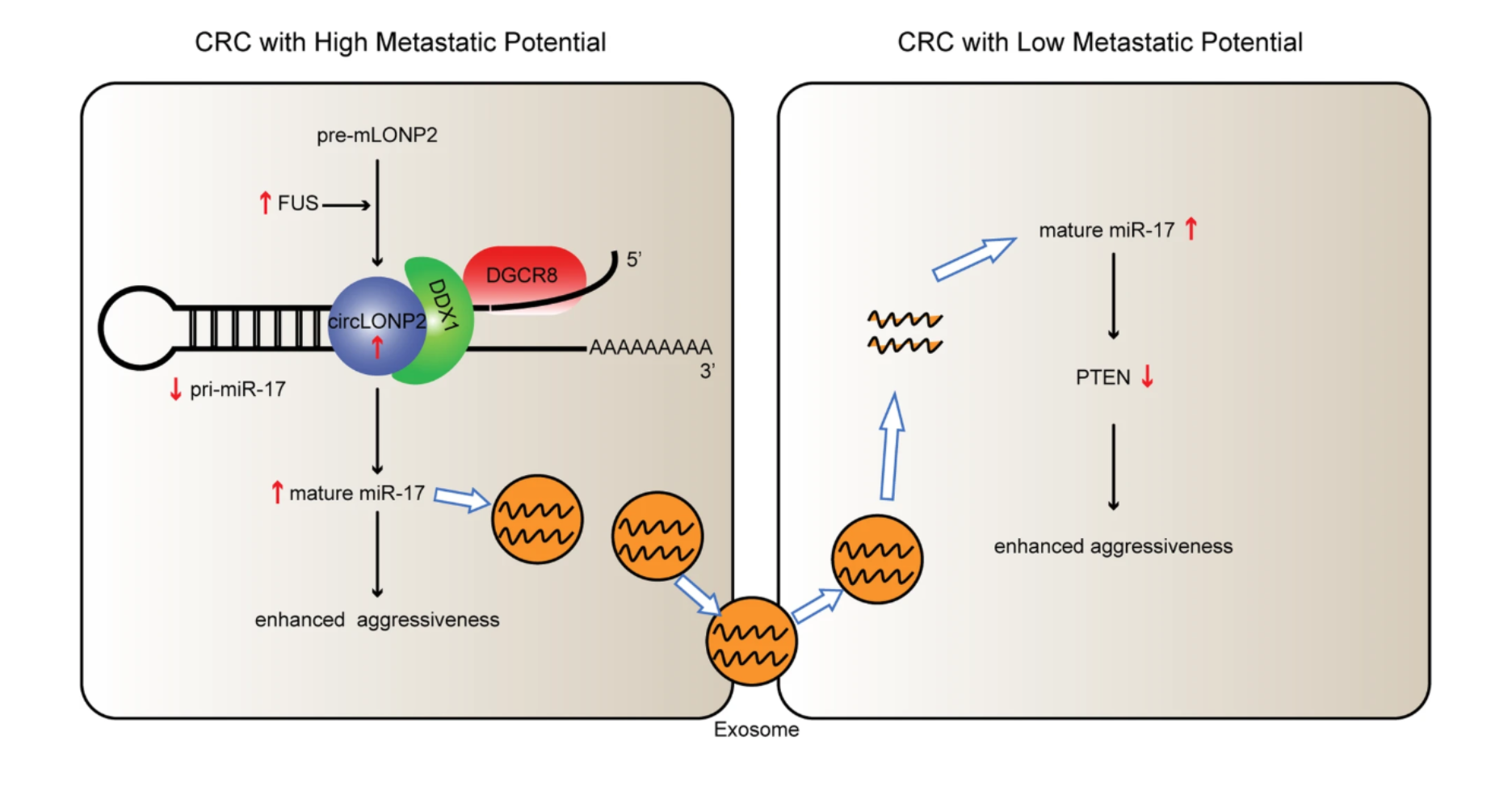
肿瘤转移是大多数结直肠癌患者死亡的原因,然而关于原发结直肠癌中转移起始细胞的具体特征和潜在机制知之甚少。近日,来自中山大学肿瘤防治中心谢丹教授课题组团队发现,环状RNA circLONP2的上调是结直肠癌转移的关键驱动因素,在临床实践中可作为新型的预后生物标志物以及治疗靶标。该研究发表于Molecular cancer杂志上。
结直肠癌(CRC)在全世界恶性肿瘤中的发病率排名第三,是癌症相关的死亡的第二大主要原因。尽管在过去的几十年中治疗效果已得到显著改善,但肿瘤转移仍然是导致癌症死亡的最大原因,也是CRC治疗最困难的挑战。转移是癌症的重要标志,通常被认为是一个多步骤的过程,在此过程中,肿瘤细胞必须经历浸润、内渗、血液中的存活、外渗以及在转移部位的定植这几个步骤。侵袭是肿瘤细胞从原发肿瘤部位迁移并离开的过程,是转移形成的第一步,也是最重要的一步。靶向原发部位那些具有高侵袭/转移潜力的癌细胞可能是抗转移治疗中的关键。然而,对于哪些癌细胞亚群启动侵袭过程以及它们如何在CRC进展过程中实现这一功能知之甚少,这就妨碍了对高转移风险的CRC患者的精确鉴定以及抗转移治疗的治疗效果。非编码RNA(ncRNA)在人类基因组中占据了绝大部分,只有2%的基因组可以转录为信使RNA(mRNA),只有信使RNA可以翻译为蛋白质。在ncRNA的所有亚型中,环状RNA(circRNA)具有特殊的环状形式,曾经被认为是转录的“垃圾”或“副产物”,是具有关键调节功能、新型且丰富的一类亚群。已鉴定出人类超过100000种circRNA。与线性mRNA不同,环状的circRNA没有5'帽或3'聚腺苷酸(poly-A)尾巴。取而代之的是,circRNA的3'和5'端共价连接在一个环中,从而形成一个独特的环形结构。circRNAs进化保守的且相对稳定,某些circRNA的表达与发育阶段或细胞类型密切相关。作为近十年中的新兴领域,circRNA由于具有特殊功能而受到关注,因为它们通过作为microRNA(miRNA)海绵或通过与RNA结合蛋白(RBP)相互作用来调节整个转录本。在许多类型的癌症中研究人员已经鉴定出一些circRNA的表达失调,并被证明在癌症进展中起着至关重要的作用。所有这些发现使得circRNA很可能成为癌症治疗中潜在的预后生物标志物和治疗靶标。但是,尚未明确阐明circRNA在CRC进展中的作用,尤其是在转移起始步骤中的作用。在这项研究中,研究人员首先采用Transwell分析建立细胞系筛选方法,获得了具有不同转移潜能的CRC亚群,然后通过高通量RNA测序确定了在CRC转移起始步骤中的新调节因子。研究人员发现,在高肿瘤转移潜能的CRC细胞中,由LONP2的外显子8-11组成的circRNA(hsa_circ_0008558)表达上调,命名为circLONP2。然后进一步进行了一系列的体外和体内试验,阐明circLONP2在CRC转移中的功能和潜在的分子机制。在转移性的原发CRC组织中以及沿转移部位的浸润边缘观察到circLONP2异常高表达,并且circLONP2的高表达预示了不良的整体生存率。功能研究表明,circLONP2可以增强体外CRC细胞的侵袭性,并且通过反义寡核苷酸(ASO)靶向circLONP2可以大大降低体内移植肿瘤的渗透性。在机制上,circLONP2通过以DDX1依赖的方式募集DGCR8和Drosha复合物,与microRNA-17(pri-miR-17)直接相互作用并促进了其加工产生。同时,成熟的miR-17-5p表达上调并可以组装到外泌体里,并被邻近肿瘤细胞内化增强其侵袭性。这项研究表明,circLONP2通过调节miR-17的细胞内成熟和细胞间转移,在CRC进展过程中充当关键的肿瘤转移起始分子,从而导致肿瘤原发部位转移起始能力的向外传播以及远端转移灶形成。circLONP2可以作为CRC治疗的有效预后指标和新的抗转移治疗靶标。参考文献:Han K, Wang FW, Cao CH, Ling H, Chen JW, Chen RX, Feng ZH, Luo J, Jin XH, Duan JL, Li SM, Ma NF, Yun JP, Guan XY, Pan ZZ, Lan P, Xu RH, Xie D. CircLONP2 enhances colorectal carcinoma invasion and metastasis through modulating the maturation and exosomal dissemination of microRNA-17. Mol Cancer. 2020; 19(1):60.
外泌体资讯网 中山大学:circLONP2通过调节miRNA-17的成熟并经外泌体扩散来帮助结直肠癌转移