乳腺癌的转移导致高死亡率,而肿瘤转移依赖于肿瘤来源的外泌体对转移前环境的相互作用,并抑制免疫细胞的正常功能,从而形成利于肿瘤转移的免疫抑制性微环境。为了解决这一问题,来自沈阳药科大学孙进、何仲贵教授课题组的研究人员开发了一种由血小板和嗜中性粒细胞细胞膜装饰的金纳米笼,并结合化学光热治疗有效消除循环肿瘤细胞和肿瘤来源的外泌体,达到抑制乳腺癌转移的目的。该研究发表于Biomaterials(IF=10.273)杂志上。
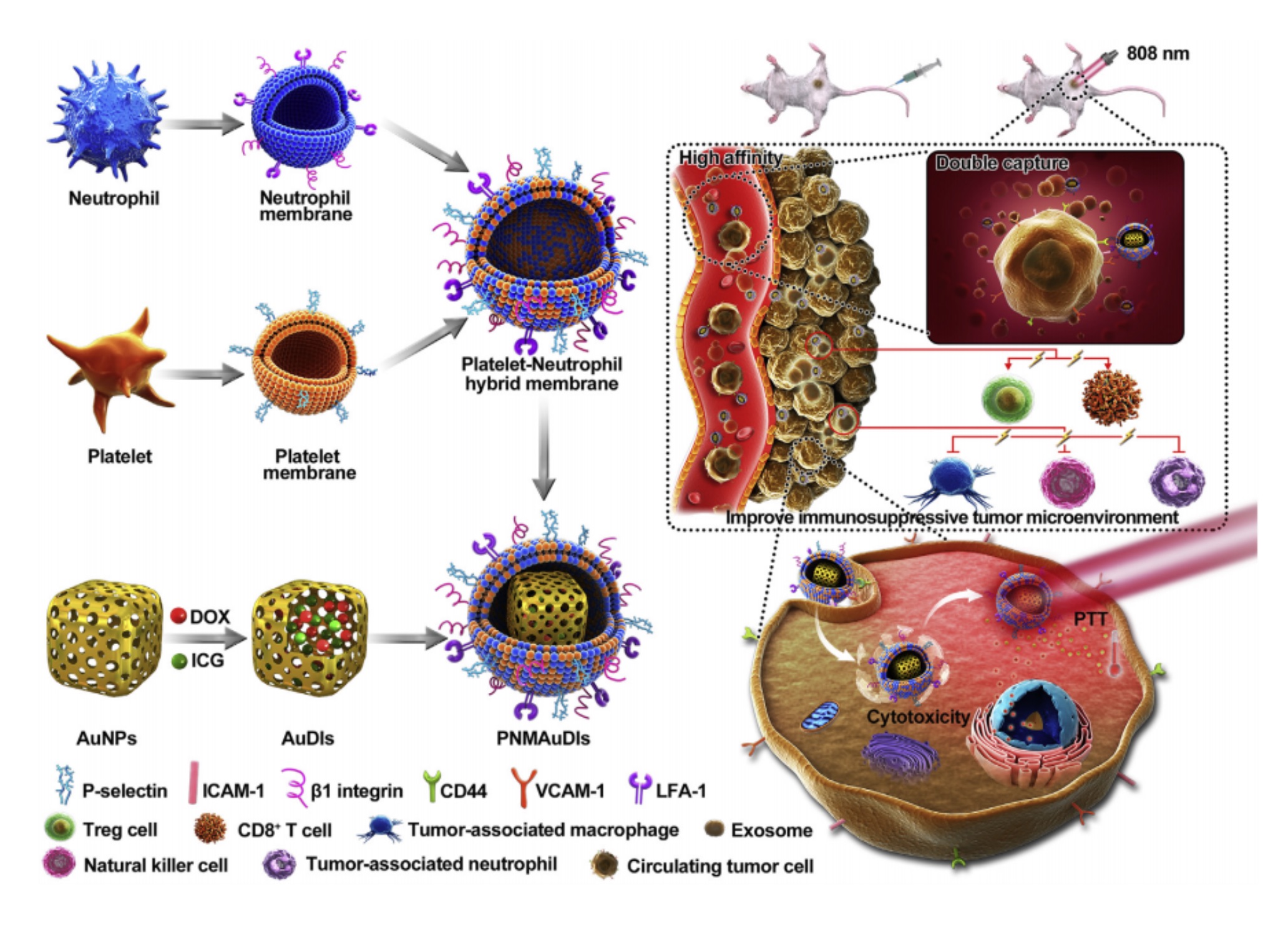 转移性乳腺癌作为一种已经扩散到其他远处器官的恶性肿瘤,约90%的乳腺癌相关的死亡是因为肿瘤转移导致的。尽管癌症治疗已取得显着进展,但不能有效提高转移性乳腺癌的生存率,其主要原因是目前的治疗方式不能有效地消除体内的循环肿瘤细胞(CTC)和肿瘤来源的外泌体。
转移性乳腺癌作为一种已经扩散到其他远处器官的恶性肿瘤,约90%的乳腺癌相关的死亡是因为肿瘤转移导致的。尽管癌症治疗已取得显着进展,但不能有效提高转移性乳腺癌的生存率,其主要原因是目前的治疗方式不能有效地消除体内的循环肿瘤细胞(CTC)和肿瘤来源的外泌体。
CTC从原发肿瘤中脱落后,成为肿瘤转移的“种子”,它们在转移前改良的微环境中,在具有合适的“土壤”的远处组织中繁殖。这种“土壤”用于CTC的“播种”,称为“转移前环境”,能够在炎性条件下繁殖生长。据报道,嗜中性粒细胞和血小板的参与能够分散肿瘤细胞,形成“早期转移性环境”,并参与促成CTC在转移前环境中播种,然后促进转移的炎症过程。中性粒细胞和血小板还通过形成中性粒细胞/血小板包围的CTC聚集体,保护血液循环中的CTC免受宿主免疫攻击和其他体内环境压力。血小板和嗜中性粒细胞的CTC靶向性和肿瘤转移微环境靶向性的潜在机制取决于生物膜上的各种黏附分子。
证据表明,肿瘤来源的外泌体影响肿瘤浸润转移整个过程的所有阶段,参与转移前环境的产生、相互作用并抑制免疫细胞的正常功能,从而形成肿瘤免疫抑制性微环境。值得注意的是,免疫研究的最新进展表明,肿瘤外泌体可以直接结合效应T细胞并抑制其活性,并且不能被单克隆抗体所阻断。
细胞膜涂层技术(cell-membrane coating)是一种具有生物界面特性的纳米粒子研究方法。张等。此前的研究揭示了一种利用血小板和红细胞混合细胞膜覆盖改善纳米颗粒功能的方法,这种膜既表现出长时间的循环又具有针对组织损伤的特异性靶向。此外,仿生细胞膜包裹的纳米颗粒被广泛用于与磁场的相互作用从而进行人CTC的特异性分离。受血小板和嗜中性粒细胞对CTC的天然靶向能力以及肿瘤细胞和肿瘤来源的外泌体之间表面受体相似性的启发,研究人员猜想,可以将血小板-嗜中性粒细胞杂交膜(PNM)包装而成的金纳米笼(AuNCs),被定义为纳米海绵(nanosponges)和纳米杀伤剂(nanokillers),将化学光热治疗剂传递给CTC和转移微环境,通过血小板和嗜中性粒细胞与CTC、外泌体之间的特异性粘附连接,消除肿瘤来源的外泌体,从而抑制肿瘤转移。而且,迄今为止尚未有报道证明转移性肿瘤外泌体的纳米海绵和纳米杀伤剂可以切断外泌体与免疫细胞之间的连接并改善免疫抑制性肿瘤微环境。
在这项研究中,研究人员将血小板和嗜中性粒细胞混合细胞膜装饰在被称为纳米海绵和纳米杀伤剂的金纳米笼表面上。纳米杀伤剂可以通过高亲和力的膜粘附受体同时捕获和清除循环中的CTC和肿瘤来源的外泌体,从而有效切断外泌体与免疫细胞之间的联系。然后研究人员在仿生纳米杀伤剂中装载阿霉素(DOX)和吲哚菁绿(ICG)进行化学光热治疗。与非包被的金纳米笼或单包被的金纳米笼相比,这种仿生纳米杀伤剂具有更高的细胞摄取能力、更强的肿瘤渗透性以及对肿瘤细胞的更高细胞毒性。在体内,多用途的仿生纳米杀伤剂不仅可以完全消融原发性肿瘤,而且可以激活先天免疫系统,在4T1异种移植瘤和原位乳腺荷瘤模型中也可以高效抑制乳腺癌转移。因此,研究团队开发的仿生纳米杀伤剂可能会成为未来乳腺癌转移临床干预的有前途的纳米药物。
参考文献:Ye H, Wang K, Lu Q, Zhao J, Wang M, Kan Q, Zhang H, Wang Y, He Z, Sun J. Nanosponges of circulating tumor-derived exosomes for breast cancer metastasis inhibition. Biomaterials. 2020 Mar 4;242:119932.




