外泌体由于其优异的生物相容性,在再生医学领域被认为是复杂细胞疗法和单一基因/药物治疗之间的有益补充,然而外泌体的低产量限制了作为基因/药物载体的应用。近日,来自华中科技大学王江林教授课题组的研究人员开发了一种工程化的外泌体类似物并建立基因激活基质,用于原位的血管化骨再生和骨修复治疗中。该研究发表于Biomaterials(IF=10.273)杂志上。
外泌体作为具有脂质双层膜的细胞外纳米囊泡,在细胞通讯中起着关键作用,并涉及细胞增殖、分化、肿瘤发生、血管生成和伤口愈合等许多生物学过程。近年来,由于先进细胞疗法和常规药物疗法之间的相互有益补充,已证实外泌体在再生医学领域中具有巨大潜力。一方面,外泌体来源于细胞,但本身不是真正的细胞,因此它可以避免传统细胞疗法的一些不良问题,比如细胞来源、治疗时间、免疫风险和医疗费用等。另一方面,外泌体不仅包含许多基因、蛋白质和生物活性成分,与细胞疗法相比具有相似的治疗潜力,而且与单一蛋白质或基因药物相比,具有更强的多功能性。尽管外泌体具有这些先天优势,但仍然存在产量低、效率不稳定、靶向性问题以及给药途径不便等缺点,这些缺点极大地影响了生物分子载体的应用。因此,在这项研究中,该研究团队将新型的外泌体类似物(exosome-mimetics,EM)与常规外泌体相比较,利用EM的高产量、相似的结构和生物标记物,构建用于局部治疗的工程化的基因激活基质(engineeredgene-activated matrix,GAM)。
GAM在局部递送和表达上具有优势,并且局部治疗的效率高,因此将组织工程与基因治疗相结合的GAM受到越来越多的关注。传统的组织工程通常应用的是生长因子蛋白质,这些蛋白质存在一些问题,例如容易降解、体内生物活性不稳定、爆发释放引起的系统毒性和高成本等。因此,Bonadio研究团队最初建议使用生长因子的基因来代替蛋白质,从而消除上述缺陷。血管内皮生长因子(VEGF)作为血管生成的关键调节因子,其作用已在血管组织工程中得到了充分证明,但目前的大多数研究都直接使用VEGF的全长蛋白,因此该蛋白几乎不能绕过上述问题,而且成本高昂。在这项工作中,该研究团队将EM作为一种特定的生物载体来封装重组VEGF165质粒,最终实现促进血管化骨再生。
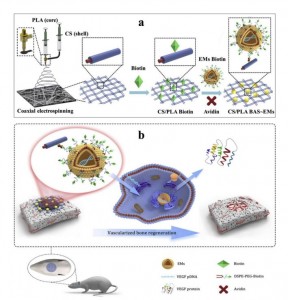
骨再生和血管生成在骨骼重塑过程中是相互支持的,而缺乏血管化作用可能会导致新形成的骨骼严重坏死,比如出现节段性骨缺损。因此,在这项工作中,该研究团队设计了一种新型的GAM,使包裹有VEGF165质粒DNA的EM诱导血管化骨再生,该EM可灵活地结合在衍生自同轴静电纺丝的核壳结构纳米纤维膜(如图示)。同轴静电纺丝技术能够在一个系统中整合各种物质,包括可混溶和不可混溶的聚合物。此外,核壳纳米纤维作为仿生细胞外基质(ECM)具有高生物活性剂负载能力,可以实现多种因子的顺序释放。
在本研究中,研究团队开发的这种外泌体类似物(EM),可以实现大规模快速生产,并且与常规外泌体相比,具有与外泌体相似的大小、形态和膜蛋白标记。为了避免静脉注射的风险并提高局部治疗的效率,研究人员应用工程改造的EM设计了基因激活基质(GAM),可以通过封装VEGF质粒并将其结合到核壳纳米纤维薄膜上,实现灵活控制局部释放。基于机械匹配、静电吸引和电纺后表面改性,研究人员选择了软壳聚糖(CS)和硬聚乳酸(PLA)并通过同轴电纺丝技术制备核壳纳米纤维膜。电纺纳米纤维外层中的CS提供了大量的氨基用于进一步修饰,而电纺纳米纤维内层中的PLA有助于提升机械强度并易于进行电纺。封装有VEGF165质粒DNA的EM可以通过Biotin-Avidin-System(BAS)灵活地连接到CS/PLA电纺纳米纤维膜上。进一步的体外和体内实验里,这种GAM能够调节VEGF165质粒的局部释放并增强血管化骨再生的效率(如图示)。
图:构建功能化GAM并诱导血管化骨再生的示意图
该研究结果表明,经过精心设计、由外泌体类似物介导的基因激活基质能够持续递送VEGF基因,并显著增强体内血管化骨再生作用。这项工作不仅可以突破了高产量外泌体的应用基础,而且还可以为局部治疗提供有效的工程化外泌体。