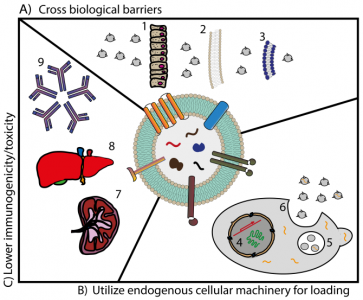
近些年出现了各种合成的纳米颗粒递送系统,并被用于改善治疗剂的药代动力学和药效动力学特征。当由输送系统携带时,治疗剂的清除率和组织分布特征主要取决于媒介物的特性,而不是取决于药物分子的理化特性。由于这个原因,已经开发了合成药物递送系统以增强药物功效和治疗效果,同时将药物毒性和脱靶副作用降至最低。脂质体、胶束、树状聚合物、纳米胶囊、纳米海绵和基于肽的纳米颗粒是这些合成药物递送系统最突出的例子。其中,研究最早且最广泛的载体是脂质体。例如,市场上的第一种脂质体制剂Doxil®已于1995年获得美国食品药品监督管理局(FDA)的批准。脂质体由可容纳疏水性药物的生物相容性脂质双分子层和可捕获亲水性药物的内部水相组成。尽管脂质体制剂具有用于治疗性递送的优势,但是对于将药物递送至靶器官仍然存在许多障碍。例如,脂质体通过网状内皮系统(RES)的快速清除以及它们在肝脏和脾脏中的积累限制了到达目标部位的剂量。此外,一些研究表明,脂质体在巨噬细胞中的积累,特别是高剂量时,会影响其吞噬活性,导致免疫抑制并阻碍细菌从血流中的清除。使用脂质体制剂的另一个缺点是急性超敏反应的激活:补体激活相关的类过敏反应(CARPA)。这种急性过敏反应触发了组胺、类胰蛋白酶和白三烯的释放,导致某些高敏感性个体的治疗中断。克服脂质体局限性的许多方法之一是转向利用天然载体系统来递送治疗剂。近来,在生物或生物启发性药物载体领域中的进展已迅速增长。细胞外囊泡(EVs)领域是当前广受关注的领域。EVs是细胞衍生的膜结构,能够将各种活性生物分子从生产细胞转运到受体细胞,从而改变受体细胞的生理。这种能力引起了人们对于EVs的广泛关注,这些EVs用于治疗应用,并作为治疗药物的前瞻性载体,可以克服与脂质体和其他合成药物递送系统有关的问题。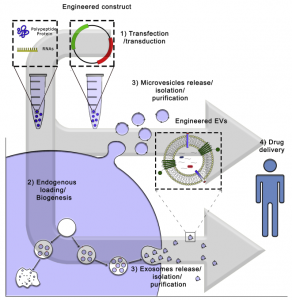
EV内源性加载策略的示意图
| | | |
| | | |
| Lamp2a, CD63, Hspa8, or Modified Lamp2b | | |
| | | 重组蛋白/Bax/superrepressor IκB |
| | | |
| | | |
| | TAT-TAR, WW-tag, or direct fusion | Wild-type P53, mRNA p53, or sgRNA/Cas9 |
由于其天然参与生物分子的细胞间交换,因此EV具有作为新型药物输送工具的巨大潜力,尤其是对于生物治疗药物的输送,可以使用内源性细胞EV包装机制将其装载到EV中。EV具有与众不同的特征,因此它们比合成的脂质载体更适合用作药物输送系统。这些包括它们突破生理屏障的能力、固有的靶向特性、利用天然细胞内运输途径的能力以及增强的生物相容性。通过工程化衍生EV的细胞,已经开发了用于加载EV并将其缀合靶向成分的各种平台。这些促使了在临床前模型中非常令人鼓舞的概念验证研究。尽管如此,需要付出更多的努力来实现EV的转化应用。临床应用需要克服的障碍包括扩大EV生产和分离过程,以及适当存放的准则。此外,越来越深入地研究EV的生物发生、货物分类、EV亚群以及受体细胞中的内化和运输途径,对于进一步了解进一步提高EV作为药物载体的策略至关重要。OmniaM Elsharkasy, Joel Z Nordin, Daniel W Hagey, Olivier G de Jong, Raymond MSchiffelers, Samir E L Andaloussi, Pieter Vader. Extracellular Vesicles asDrug Delivery Systems: Why and How? Adv Drug Deliv Rev.2020 Apr 16;S0169-409X(20)30024-7.外泌体资讯网 【综述】细胞外囊泡作为药物递送系统:Why and How?