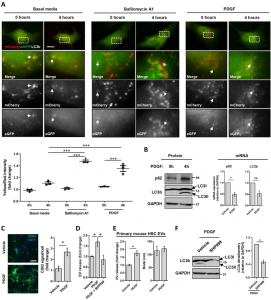
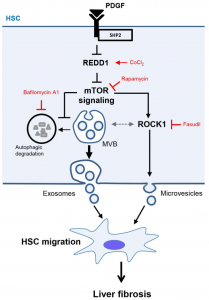
近日,来自梅奥医学中心的研究人员在Journal of Hepatology杂志上发表文章(来自四川大学华西医院的Jinhang Gao为第一作者),报道了在肝星状细胞(Hepatic StellateCells, HSCs)中,自噬抑制了促进纤维化的EV释放,从而可以减轻肝纤维化。 自噬是真核生物中的一种降解过程,在该过程中,名为自噬体的双膜囊泡与溶酶体融合,降解胞质蛋白和细胞器。自噬促进肝脏稳态,自噬失调与几种慢性肝病有关。自噬在肝病中的作用取决于细胞类型和疾病阶段。在肝细胞中,自噬已被证明具有保护作用,而在肝星状细胞(HSC)中,自噬被认为通过脂吞噬(一种选择性的脂滴降解类型)诱导其活化。然而,自噬抑制剂哺乳动物雷帕霉素靶蛋白(mTOR)促进HSC活化和肝纤维化。因此,解析自噬与纤维化信号放大有关的微调机制将增进我们对肝脏纤维化的了解。细胞外囊泡(EVs)已成为肝损伤和纤维化进展中重要的细胞衍生颗粒。小EV的范围为50-150 nm,起源于质膜出芽的富含ADP核糖基化因子6(Arf6)的微囊泡,或者,起源于多泡体(MVB)的富含CD63和CD81的外泌体。EVs通过传递各种货物参与了细胞间通信。在肝脏中,受伤的肝细胞和窦状内皮细胞(LSEC)产生的EV诱导HSC活化和迁移。有趣的是,响应肝损伤,EV释放增加,而自噬或溶酶体降解的抑制与EV释放增加相关。然而,人们对致病性EV的释放缺乏了解。更具体地说,自噬如何调节促纤维化的HSC-EV的生物发生。肝纤维化进展中的关键分子之一是血小板衍生的生长因子(PDGF),由LSEC、Kupffer细胞和HSC释放。PDGF是体外研究的必不可少的工具,因为它可以诱导HSC的活化和迁移,HSC是纤维化过程中参与基质沉积的主要细胞类型。在HSC中,PDGF与PDGF受体(PDGFR)结合会诱导酪氨酸自磷酸化,从而募集重要的下游信号分子,例如Src同源2域蛋白磷酸酶2(SHP2)。最近,已证明成纤维细胞SHP2诱导皮肤和肺纤维化。以前的研究也证明了PDGF和SHP2可以促进源自HSC的EV富含纤维蛋白。基于此,该研究将PDGF/SHP2模型用作研究自噬在HSC-EV释放和肝纤维化中的作用的平台。在体外,PDGF及其下游分子SHP2抑制自噬并增加HSC衍生的EV释放。使用PDGF/SHP2模型进一步研究自噬如何影响纤维化EV释放。RNA-seq鉴定了一个mTOR信号分子,该信号分子受SHP2和PDGF调控。mTOR信号的破坏消除了PDGF依赖的EV释放。mTOR信号的激活抑制自噬以及ROCK1信号的激活引起的微泡,诱导了MVB来源的外泌体的释放。这些依赖mTOR的EV促进了体外HSC迁移。为了评估该机制在体内的重要性,在HSC中选择性删除了SHP2,从而减弱了CCl4或BDL诱导的肝纤维化。此外,与对照小鼠的EV相比,HSC特异性SHP2缺失小鼠来源的循环EV处理CCl4介导的纤维化小鼠后,其纤维化程度较小。此外,肝硬化患者中的SHP2上调。该研究证明了在HSC中抑制自噬,激活Rho相关蛋白激酶1(ROCK1)信号,最后通过mTOR 促进EV释放。这种EV释放机制参与了肝纤维化进程。总之,HSC的自噬通过减弱纤维化的HSC衍生的EV释放来减少肝纤维化。1.PDGF和SHP2通过激活mTOR信号诱导纤维化EV释放。2.mTOR信号抑制自噬,导致MVB来源的外泌体释放。3.mTOR信号激活ROCK信号,导致质膜来源的微泡释放。4.在体内阻断该机制可抑制促纤维化外泌体和微泡释放到循环中,并最终抑制小鼠的肝纤维化。作用模式图。在HSC中,PDGF和SHP2抑制REDD1表达,以扩大mTOR信号传导。反过来,mTOR通过抑制MVB自噬降解促进外泌体释放;通过激活ROCK1信号促进微泡释放。这些外泌体和微囊泡诱导其他HSC迁移,导致促纤维化信号放大和体内肝纤维化。在此方案中,CoCl2刺激REDD1表达,雷帕霉素抑制mTOR,巴氟霉素A1抑制自噬降解,法舒地尔抑制ROCK1信号传导。GaoJ, Wei B, de Assuncao TM, Liu Z, Hu X, Ibrahim S, Cooper SA, Cao S, Shah VH,Kostallari E. Hepatic stellate cell autophagy inhibits extracellular vesiclerelease to attenuate liver fibrosis. J Hepatol. 2020May 7. pii: S0168-8278(20)30290-7. doi: 10.1016/j.jhep.2020.04.044.
自噬是真核生物中的一种降解过程,在该过程中,名为自噬体的双膜囊泡与溶酶体融合,降解胞质蛋白和细胞器。自噬促进肝脏稳态,自噬失调与几种慢性肝病有关。自噬在肝病中的作用取决于细胞类型和疾病阶段。在肝细胞中,自噬已被证明具有保护作用,而在肝星状细胞(HSC)中,自噬被认为通过脂吞噬(一种选择性的脂滴降解类型)诱导其活化。然而,自噬抑制剂哺乳动物雷帕霉素靶蛋白(mTOR)促进HSC活化和肝纤维化。因此,解析自噬与纤维化信号放大有关的微调机制将增进我们对肝脏纤维化的了解。细胞外囊泡(EVs)已成为肝损伤和纤维化进展中重要的细胞衍生颗粒。小EV的范围为50-150 nm,起源于质膜出芽的富含ADP核糖基化因子6(Arf6)的微囊泡,或者,起源于多泡体(MVB)的富含CD63和CD81的外泌体。EVs通过传递各种货物参与了细胞间通信。在肝脏中,受伤的肝细胞和窦状内皮细胞(LSEC)产生的EV诱导HSC活化和迁移。有趣的是,响应肝损伤,EV释放增加,而自噬或溶酶体降解的抑制与EV释放增加相关。然而,人们对致病性EV的释放缺乏了解。更具体地说,自噬如何调节促纤维化的HSC-EV的生物发生。肝纤维化进展中的关键分子之一是血小板衍生的生长因子(PDGF),由LSEC、Kupffer细胞和HSC释放。PDGF是体外研究的必不可少的工具,因为它可以诱导HSC的活化和迁移,HSC是纤维化过程中参与基质沉积的主要细胞类型。在HSC中,PDGF与PDGF受体(PDGFR)结合会诱导酪氨酸自磷酸化,从而募集重要的下游信号分子,例如Src同源2域蛋白磷酸酶2(SHP2)。最近,已证明成纤维细胞SHP2诱导皮肤和肺纤维化。以前的研究也证明了PDGF和SHP2可以促进源自HSC的EV富含纤维蛋白。基于此,该研究将PDGF/SHP2模型用作研究自噬在HSC-EV释放和肝纤维化中的作用的平台。在体外,PDGF及其下游分子SHP2抑制自噬并增加HSC衍生的EV释放。使用PDGF/SHP2模型进一步研究自噬如何影响纤维化EV释放。RNA-seq鉴定了一个mTOR信号分子,该信号分子受SHP2和PDGF调控。mTOR信号的破坏消除了PDGF依赖的EV释放。mTOR信号的激活抑制自噬以及ROCK1信号的激活引起的微泡,诱导了MVB来源的外泌体的释放。这些依赖mTOR的EV促进了体外HSC迁移。为了评估该机制在体内的重要性,在HSC中选择性删除了SHP2,从而减弱了CCl4或BDL诱导的肝纤维化。此外,与对照小鼠的EV相比,HSC特异性SHP2缺失小鼠来源的循环EV处理CCl4介导的纤维化小鼠后,其纤维化程度较小。此外,肝硬化患者中的SHP2上调。该研究证明了在HSC中抑制自噬,激活Rho相关蛋白激酶1(ROCK1)信号,最后通过mTOR 促进EV释放。这种EV释放机制参与了肝纤维化进程。总之,HSC的自噬通过减弱纤维化的HSC衍生的EV释放来减少肝纤维化。1.PDGF和SHP2通过激活mTOR信号诱导纤维化EV释放。2.mTOR信号抑制自噬,导致MVB来源的外泌体释放。3.mTOR信号激活ROCK信号,导致质膜来源的微泡释放。4.在体内阻断该机制可抑制促纤维化外泌体和微泡释放到循环中,并最终抑制小鼠的肝纤维化。作用模式图。在HSC中,PDGF和SHP2抑制REDD1表达,以扩大mTOR信号传导。反过来,mTOR通过抑制MVB自噬降解促进外泌体释放;通过激活ROCK1信号促进微泡释放。这些外泌体和微囊泡诱导其他HSC迁移,导致促纤维化信号放大和体内肝纤维化。在此方案中,CoCl2刺激REDD1表达,雷帕霉素抑制mTOR,巴氟霉素A1抑制自噬降解,法舒地尔抑制ROCK1信号传导。GaoJ, Wei B, de Assuncao TM, Liu Z, Hu X, Ibrahim S, Cooper SA, Cao S, Shah VH,Kostallari E. Hepatic stellate cell autophagy inhibits extracellular vesiclerelease to attenuate liver fibrosis. J Hepatol. 2020May 7. pii: S0168-8278(20)30290-7. doi: 10.1016/j.jhep.2020.04.044.外泌体资讯网 J Hepatol:肝星状细胞自噬抑制细胞外囊泡释放以减轻肝纤维化