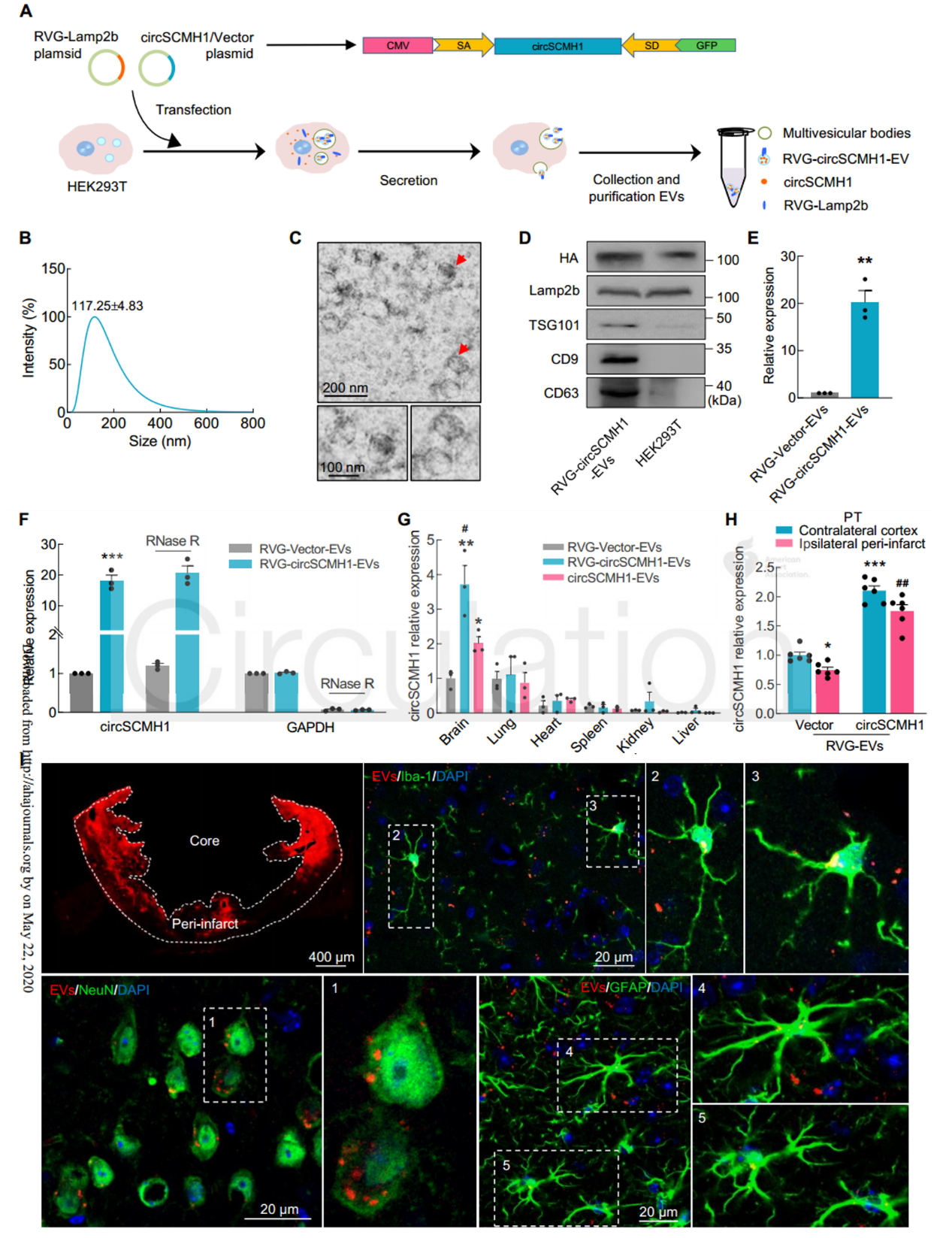
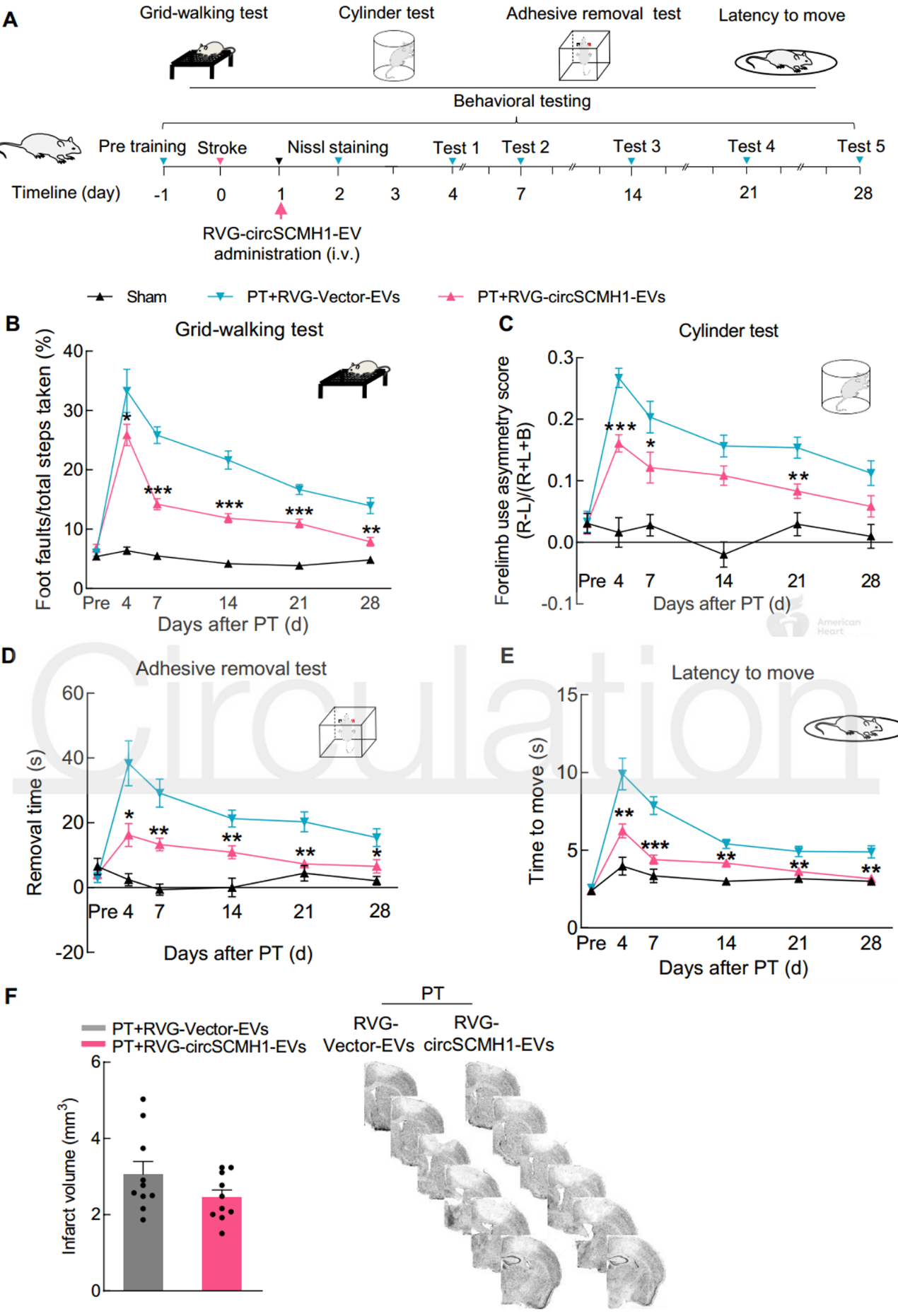
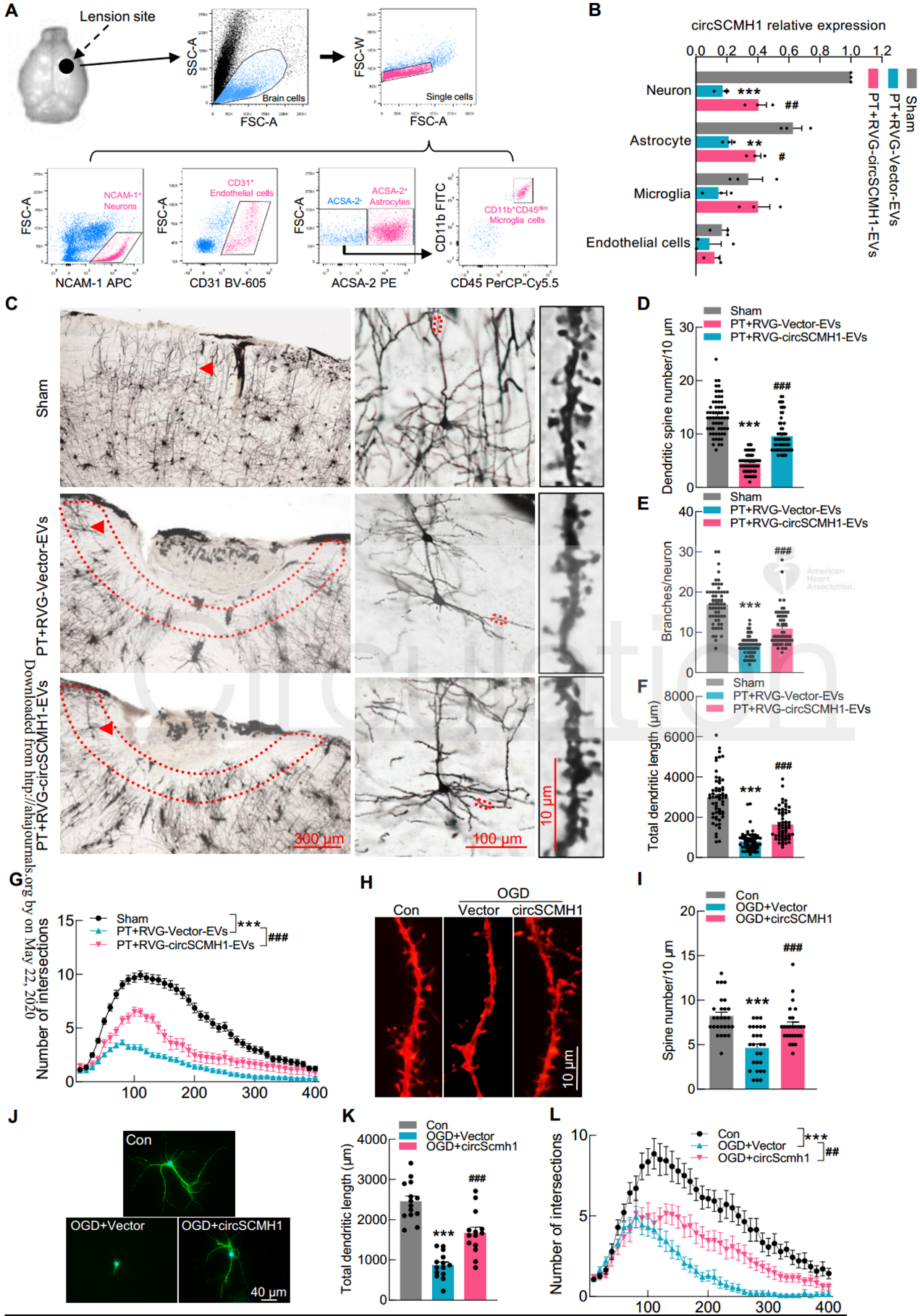
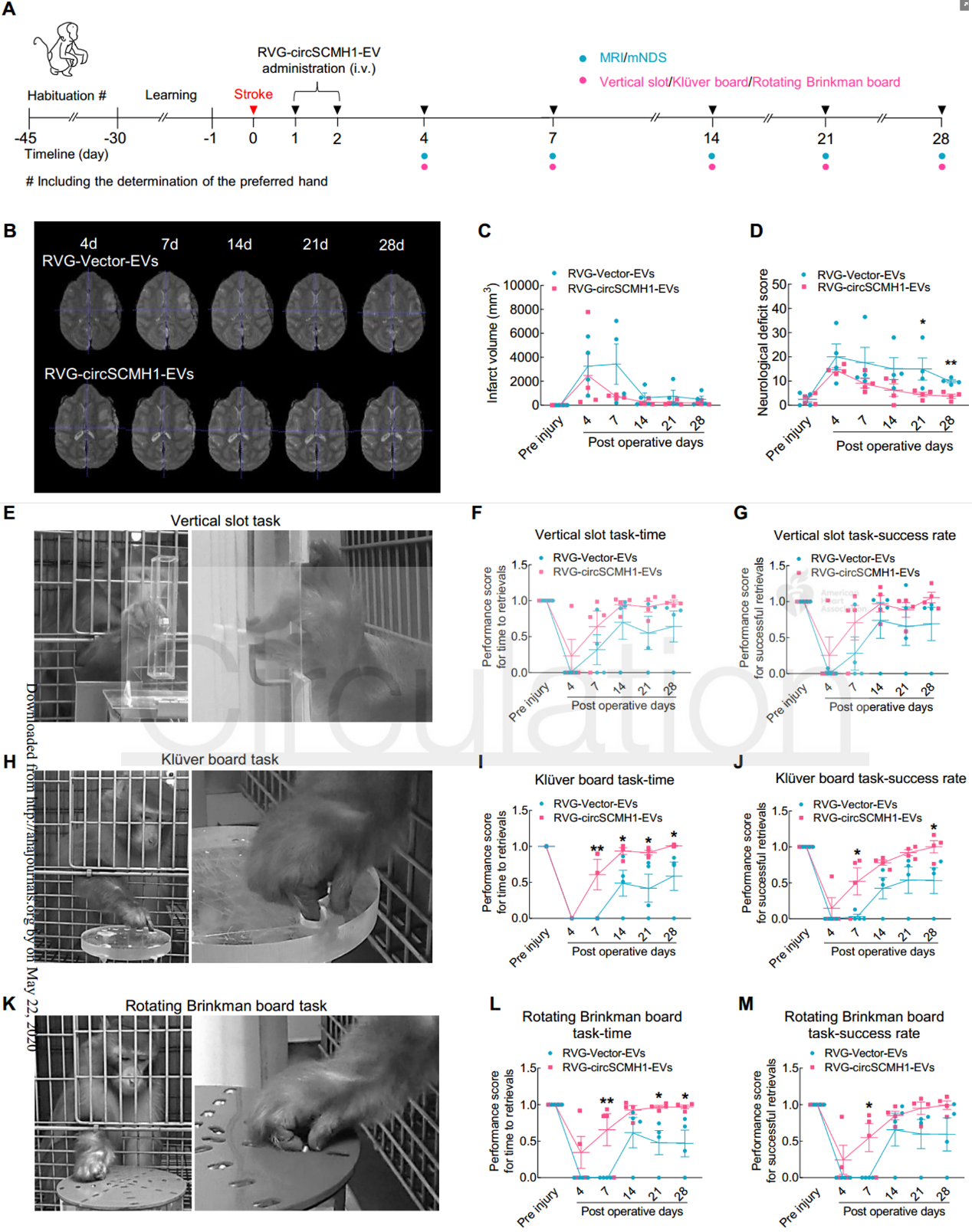
近日,来自东南大学医学院姚红红教授和中科院昆明动物研究所王建红研究员合作在国际顶尖心血管领域杂志Circulation上发表文章,报道了通过Lamp2b-RVG工程化的细胞外囊泡向大脑靶向递送环状RNA circSCMH1,在小动物和大动物卒中模型中发挥保护作用。缺血性卒中是一种常见的神经系统疾病,是永久性残疾的主要原因。迄今为止,几乎没有报道过任何能提高卒中恢复率和改善长期预后的治疗药物。最常用的治疗方式可能是,组织纤溶酶原激活剂,溶栓治疗的治疗窗口很短,甚至及时溶栓也可能无法预防长期的神经功能缺损。因此,促进卒中的恢复和增强长期功能结局仍然是一个迫切的研究领域,因为这可以使大量患者受益。环状RNA(circRNA)是一种内源性非编码RNA分子,其特征是反向剪接和共价闭合的连续环。先前的研究表明,circRNA在大脑中含量很高,并且在功能上涉及神经系统疾病和其他疾病。然而,circRNA的生理功能和致病作用仍未得到充分探索,人们对此知之甚少。以前的研究表明,多种circRNA具有与缺血性脑损伤相关的功能性作用。尽管使用慢病毒施用circRNA可以有效地进行实验论证,但由于起效时间和安全性方面的缺点,该途径在临床转化中受到限制。胞外囊泡(EV)用作卒中后大脑重塑的货物运输系统的潜力潜在地解决了这些问题。细胞释放的EVs,直径为30-150 nm的脂质膜囊泡,可以穿过血脑屏障(BBB),并已被证明能够载运蛋白质、脂质和核苷酸。令人兴奋的是,一项突破性的研究证明了狂犬病毒糖蛋白(RVG)可以通过融合蛋白溶酶体相关膜糖蛋白2b(Lamp2b)-RVG进行工程化,定位在EV的表面,从而有可能实现针对大脑的靶向。该报道设想了通过构建携带circRNA的工程EV在体内将候选circRNA传递到大脑的潜力。该研究在缺血性脑损伤中探索了这种circRNA递送策略。对急性缺血性卒中(AIS)患者进行的基于微阵列的分析显示,AIS患者血浆中由SCMH1基因生成的circRNAcircSCMH1在AIS患者的血浆中减少,并且在卒中模型小鼠中也是如此。该研究成功地设计了circSCMH1过表达的EV(与Lamp2b-RVG结合用于靶向大脑),因此能够在小鼠和猕猴的卒中模型中通过实验表征circSCMH1与缺血相关的功能益处。circSCHM1的RVG-EV递送增强了光化学诱导血栓形成小鼠的功能恢复circSCMH1的过表达在体内和体外均促进神经元可塑性CircSCMH1促进非人类灵长类动物卒中后运动功能的恢复- 在circRNA微阵列筛选中鉴定到的CircSCMH1在AIS患者和卒中小鼠的血浆中显著降低
- 卒中后静脉注射工程化的RVG-circSCMH1-EVs可以显著增强啮齿动物模型和非人类灵长类动物模型的功能恢复
- CircSCMH1与转录因子MeCP2结合,从而上调了维持大脑功能的MeCP2下游基因的转录
- 工程化的circSCMH1-EV可以增强非人灵长类动物卒中后的功能恢复,并有待进一步的临床开发
- 工程circSCMH1-EV可能会扩大卒中的治疗窗口
Yang,L., et al. Extracellular Vesicle-Mediated Delivery of CircSCMH1 PromotesFunctional Recovery in Rodent and Nonhuman Primate Ischemic Stroke Models. Circulation.2020 May 22. doi: 10.1161/CIRCULATIONAHA.120.045765.外泌体资讯网 Circulation:细胞外囊泡靶向递送circRNA促进鼠/猴缺血性脑卒中模型的功能恢复