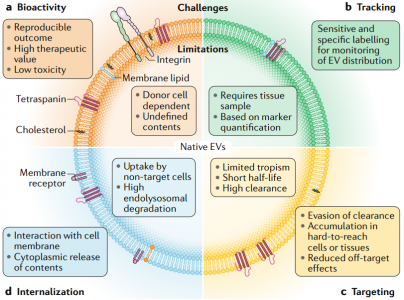
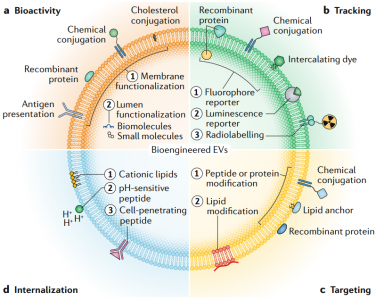
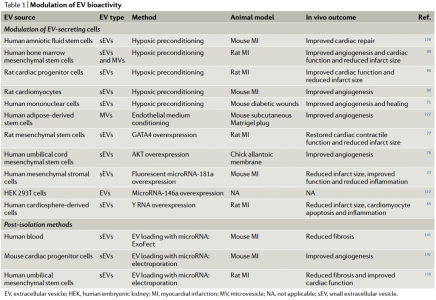
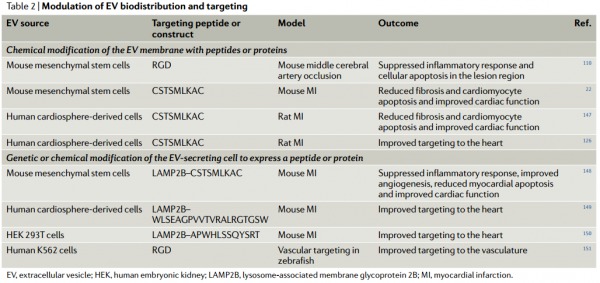
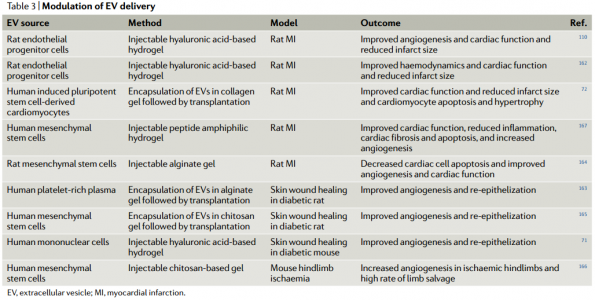
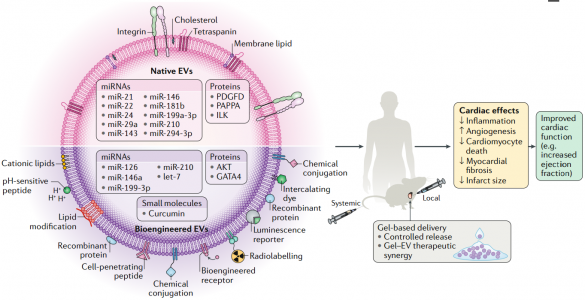
近日,Nature子刊NatureReviews Cardiology杂志发表细胞外囊泡治疗心血管疾病的综述,概述了细胞外囊泡作为无细胞治疗剂治疗心血管疾病的优势和挑战,分天然和生物工程化两大块进行了总结,探讨了未来的发展方向。尽管数十年来已取得了许多突破和发现了新颖的疗法,但心血管疾病仍然是世界上发病率和死亡率最高的病因。在过去的20年中,已经开始了几种治疗性干预措施,包括基于细胞的治疗;然而,心脏组织缺血环境中移植细胞的存活和/或整合性差,限制了它们的临床疗效。从机理上讲,人们对细胞疗法所观察到的功能改善知之甚少;实验数据表明它们可能通过旁分泌作用发挥作用,介导细胞外囊泡(EVs)和/或其他因子的释放。因此,人们对无细胞疗法尤其是涉及EV的疗法的开发兴趣日益增长,从而消除了移植大量细胞的需求,同时也拥有了定义更明确、价格更低廉的产品。EVs是一种细胞外结构,被脂质双层包裹,几乎所有已知的细胞类型都可以分泌。EVs的两个主要类别是外泌体和微泡。外泌体(直径为30-150 nm)是腔内囊泡,由多囊泡内体膜的内陷形成,并在多囊泡内体与细胞膜融合后释放到细胞外空间。微泡(直径为50–1,000 nm)是一组高度异质的EV,其特征在于它们的起源和分泌是通过质膜向外出芽。考虑到鉴定其生物发生的复杂性,囊泡的大小是用于对EV类型进行分类的最广泛使用的参数,并在此基础上被描述为小型EV或中大型EV。在该综述中,术语“EVs”用于指代富含小EVs的样本(许多研究并未提供有关EVs生物起源的结论性信息),除非在讨论涉及微泡的例子时明确提及。EVs携带蛋白质、RNA和/或microRNA(miRNA)等,并在细胞间通信中起载体的作用。大量证据表明,EVs参与许多生理和病理性心血管过程,包括血管生成、血压控制、心肌肥大、细胞凋亡和/或生存和心脏纤维化的调控。鉴于它们普遍存在于诸如血液和尿液等体液中,EVs已被用作心血管疾病的潜在生物标志物。此外,由于EVs是干细胞疗法旁分泌作用的重要组成部分,因此EVs是心血管疾病的无细胞疗法。开拓性的临床前研究强调了EVs在保护心脏免受缺血性损伤中的治疗潜力。据报道在肢体缺血的情况下EVs具有促血管生成的潜力。其他各种临床前研究也报道了EVs在心血管再生和保护方面的优势。然而,在这些疗法的临床转化之前,需要解决一些挑战。需要开发平台以在体内监测EVs(膜和货物),以确定和优化EVs的剂量方案、给药途径、生物分布以及潜在的毒性、免疫原性和肿瘤发生。其次,需要对EVs组成成分进行表征,以便使用定义明确的EVs组分。第三,必须制定策略来修改EVs的膜,以改善其在特定器官和组织中的积累。 为了克服这些局限性,研究人员开发了分离前和分离后技术,这些技术可以调节天然EVs的内在特性并修饰其表面,以提高其靶向效率并促进体内追踪。在这篇综述中,作者建议通过生物工程对EVs进行调节将释放其在治疗心血管疾病方面的临床潜力。首先,讨论EVs的生物物理特性,例如尺寸、电荷、膜成分和货物成分。接下来,介绍天然EVs对心血管应用的治疗潜力。还描述了生物工程策略,以调节EVs的内容,以改善其生物活性、生物分布、传递、靶向和细胞内运输。最后,总结了使用生物工程EVs作为心血管疗法的研究,并讨论了该领域如何发展。总体而言,增加心血管系统中EV积累从而减少所需剂量的靶向技术,以及用特定生物分子丰富EV含量的策略可能是其在临床中成功使用的关键。EV跟踪技术的使用将改善我们对EV生物分布的机制理解。此外,用外源分子装载EV并控制其体内传递动力学将产生增加EV生物活性的机会。最终,生物工程EV是一种有前途的、无细胞、强大且可定制的转化方法,可以改善心血管疾病患者的预后。RicardoCerqueira de Abreu, Hugo Fernandes, Paula A da Costa Martins, Susmita Sahoo,Costanza Emanueli, Lino Ferreira. Native and Bioengineered Extracellular Vesiclesfor Cardiovascular Therapeutics. Nat Rev Cardiol. 2020Jun 1. doi: 10.1038/s41569-020-0389-5.外泌体资讯网 Nature子刊综述:天然和生物工程化的细胞外囊泡用于心血管疾病治疗