细胞衰老是个体衰老的标志,其特征在于细胞周期退出和分泌表型,其中包括小细胞外囊泡(sEVs)的分泌。最近发表于Cell Metabolism杂志(影响因子21.567)的研究指出,年轻个体的细胞分泌的sEV可以通过减少氧化应激来改善老年个体细胞中的衰老。该研究在近期的NatureReviews Molecular Cell Biology杂志(影响因子55.47)上进行了Highlight推荐。

该研究团队先前的研究表明,老年个体细胞(“旧细胞”)分泌的sEV可以旁分泌方式将衰老特征介导给年轻个体增殖的细胞(“年轻细胞”)。为了确定年轻细胞中的sEV是否能改善老细胞中与衰老相关的表型,作者在体外研究了三种细胞类型:老成纤维细胞、H-RAS致癌基因过度表达诱导衰老的年轻成纤维细胞(iRAS细胞)和来自早衰综合症(Hutchison-Gilford progeria syndrome, HGPS)个体的成纤维细胞。
研究人员从年轻的(Y)人类供体成纤维细胞中获得了条件培养基,并将其分为含有小和大细胞外囊泡(分别为sEV-Ys和lEV-Ys)的两部分。sEV-Ys处理老成纤维细胞,阻止了老成纤维细胞的增殖停滞,并且减少了表达衰老标记的老细胞的数量;而lEV-Ys处理的没有这一现象。用sEV-Ys处理HGPS成纤维细胞后,获得了相似的结果。
该小组先前对sEV进行的蛋白质组学分析已鉴定出诱导iRAS细胞后其表达水平发生变化的蛋白质。网络分析揭示了其中一些蛋白质与谷胱甘肽结合途径之间的联系,这抵消了活性氧(ROS)的衰老诱导作用。具体而言,在iRAS-sEV中,谷胱甘肽S-转移酶Mu 2(GSTM2)的表达显著降低。与HGPS-sEV相比,GSTM2富含于sEV-Y。
由于GST活性从sEV-Ys传递到老细胞,因此将sEV-Ys添加到培养基中可抑制ROS积累和老细胞中的DNA损伤,从而降低氧化应激。此外,用GSTM2转染来自老细胞的sEV,并随后用这些sEV处理老细胞降低了衰老标记的表达。
与这些体外结果一致,在老小鼠中腹膜内注射sEV-Ys导致肝脏、肾脏、褐色脂肪组织和血清中的衰老标志物减少,且在肺部中更少。ROS水平降低,并且在测试的组织中,GSTM2活性(通常在老年小鼠中较低)增加到年轻小鼠中所见的水平。最后,用sEV-Ys处理老年小鼠导致在各种组织中的脂质过氧化标记减少,这与脂质过氧化产物是GSTM2的内源性底物的事实相一致。
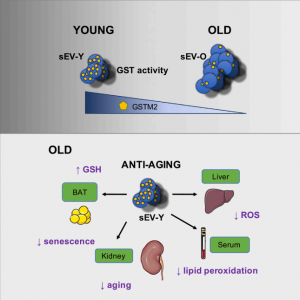
模式图
研究要点:
- sEV-Ys改善衰老和衰老的某些细胞生物标志物
- 与sEV-O相比,sEV-Y富含GSTM2
- sEV-Ys具有固有的GST活性,可增加小鼠和人类的GSH水平
- sEV-Ys减少年老小鼠和人成纤维细胞中ROS的积累和脂质氧化
总而言之,这项研究阐明了年轻个体的sEV改善衰老相关细胞损伤的潜力。
参考文献:
JuanAntonio Fafián-Labora, Jose Antonio Rodríguez-Navarro, Ana O'Loghlen. SmallExtracellular Vesicles Have GST Activity and Ameliorate Senescence-RelatedTissue Damage Cell Metabolism. 2020 Jul7;32(1):71-86.e5. doi: 10.1016/j.cmet.2020.06.004. Epub 2020 Jun 22.
AnnaMelidoni Small extracellular vesicles combat senescence NatureReviews Molecular Cell Biology. 2020 Jul 13. doi: 10.1038/s41580-020-0271-7.Online ahead of print.
外泌体资讯网 Cell Metabolism:小细胞外囊泡可抵抗衰老




