胃癌是世界范围内发病率排名第五的癌症,致死率排名第三。且胃癌病人预后一般较差,5年生存期不到10%;而胃癌病人预后差的一个主要原因就是转移的发生。因此,深入了解胃癌转移的发生机制将为提出有效地治疗方案提供理论基础。
LSD1是2004发现的首个组蛋白赖氨酸去甲基化酶,可以特异性去除H3K4和H3K9的单、双甲基化修饰以及一些非组蛋白赖氨酸的甲基化修饰。LSD1高表达于多种癌组织中,且越来越多的报道指出LSD1作为表观调控因子,参与多种肿瘤进程及胚胎发育。2018年Shi Yang教授报道指出LSD1缺失可通过降低RISC复合物稳定性进而引起细胞内双链RNA的蓄积,指出LSD1可能调节miRNA的形成。
作者利用组织芯片联合免疫组化技术发现,LSD1于胃癌组织中高表达,且LSD1的高表达与胃癌转移能力密切相关。细胞水平缺失LSD1或者抑制LSD1活性均能显著抑制胃癌细胞转移能力。深入分子机制研究发现,miR-142-5p作为中间桥梁靶向抑制转移抑制蛋白CD9表达,LSD1缺失可通过降低细胞内miR-142-5p的水平增加CD9的量,进而抑制胃癌转移。作者进一步研究发现,LSD1的缺失可促进miR-142-5p被包裹进多泡体内,进而成为sEVs的小RNA组分,从而通过sEVs向外排出miR-142-5p,降低细胞内miR-142-5p含量,上调CD9表达并抑制胃癌细胞转移。
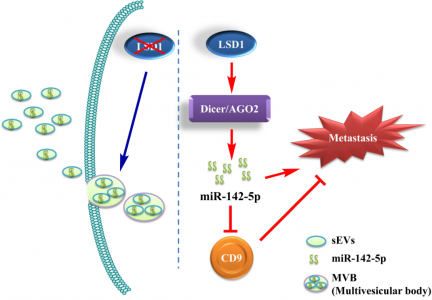
本文研究证实LSD1可通过sEVs调节miRNA分泌,发现了miR-142-5p新的靶蛋白-CD9,进一步丰富了miR-142-5p发挥功能的新途径;而sEVs可包裹miR-142-5p并将其排出细胞,降低细胞内miR-142-5p丰度。本研究揭示了LSD1调节胃癌转移的新通路,提示miRNA去路的新途径。





