
外泌体是阿尔茨海默氏病(AD)生物标志物的新标志物。来自首都医科大学宣武医院神经疾病高创中心贾建平教授课题组的研究人员在一项临床研究中提示了外泌体突触蛋白具有在无症状阶段预测AD的能力,外泌体GAP43、神经颗粒蛋白,SNAP25和突触结合蛋白1可在发生认知障碍之前的5至7年预测AD并作为有效生物标志物。该研究发表于Alzheimers & Dementia杂志上(IF=17.127)。
阿尔茨海默氏病(AD)是最常见的老年痴呆症类型,并且是全球65岁以上老年人致残的主要原因。因此,对AD进行有效治疗非常迫切。然而,治疗AD引起的认知障碍发生的临床试验面临巨大挑战。大量证据表明,在痴呆症发作之前的正常老年人中已经开始有临床的病理生理表现。AD的病理学的临床范围很广,包括认知正常、轻度认知障碍(MCI)和痴呆。这表明,如果治疗在较早的阶段开始,例如在MCI甚至认知正常阶段,则可能会延迟临床症状的发作。这些策略需要在无症状阶段采用合适的支持性方法来早期检测AD。
突触功能障碍与AD有关。越来越多的证据表明,AD的病理特征是β淀粉样蛋白(Aβ)和P-tau引起了突触病理变化,甚至在无症状阶段也会发生。例如,AD患者的脑组织表现出降低的突触蛋白水平,包括生长相关蛋白43(GAP43)、神经颗粒蛋白、突触标签蛋白、Rab3A、突触体相关蛋白25(SNAP25)。此外,在AD患者的脑脊液(CSF)中还观察到了GAP43、神经颗粒蛋白、SNAP25和突触结合蛋白1的表达增加,表明这些蛋白有可能作为AD的生物标志物。由于突触损伤发生在AD的无症状阶段,因此本研究探索了突触蛋白是否可以作为AD无症状阶段的预测因子。
外泌体是由许多细胞类型(包括神经元)分泌的转运微粒(30-100 nm)。外泌体的小尺寸及其与细胞结构的相似性使它们能够轻松穿越血脑屏障并从中枢神经系统中消除病理性蛋白质。据报道,外泌体Aβ和tau的变化是AD的特征之一,研究人员已证明神经元来源的外泌体是AD生物标志物的理想候选者。尽管据报道MCI患者的脑脊液中有几种突触蛋白发生了改变,但尚未完全了解在AD的临床前阶段是否可以检测到血液中突触蛋白的变化。有研究报道,AD患者或临床前AD患者的神经元来源的外泌体显示出几种突触蛋白水平降低,这表明即使在非症状阶段,外泌体突触蛋白也可能是预测AD的生物标志物。然而,这些研究提供的数据患者数量较少(9名临床前AD患者),并且未经CSF的分析验证,其临床转化应用比较局限。
在这项临床研究里,研究人员进行了一个两阶段的研究(探索阶段:28名AD患者,35名轻度认知障碍[aMCI]患者,29名对照组;验证阶段:73名AD,71名aMCI,72名对照组),研究涵盖临床前AD(160名)和对照(160名),以及家族性AD的确证研究(59名突变携带者,62名非突变携带者)。结果显示,AD患者的GAP43、神经颗粒蛋白、SNAP25和突触标签蛋白1的浓度低于对照组(P <0.001)。外泌体生物标志物水平与脑脊液中的水平显著相关(R2 = 0.54-0.70)。外泌体生物标志物的组合在出现认知障碍之前的5至7年就可以检测到AD的发生(AUC = 0.87-0.89)。
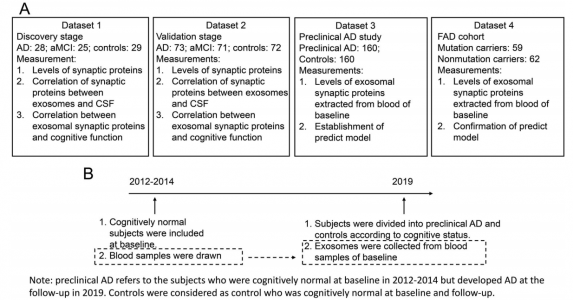
图:本研究纳入的四个数据集
因此,这项研究确立了外泌体GAP43、神经颗粒蛋白、SNAP25和突触结合蛋白1具有诊断AD和轻度认知障碍(aMCI)的能力,并且从CSF获得的数据能够验证外泌体生物标志物的结果,最终证实外泌体生物标记物在AD患者出现认知障碍之前就有检测临床前AD的能力。




