外泌体上表达的蛋白质是有希望的液体活检生物标志物用于癌症诊断。然而,外泌体蛋白谱分析在技术上仍然具有挑战性。近日,来自南开大学刘定斌、高红梅和中南大学荣鹏飞课题组的研究人员报告了一种纳米酶辅助免疫吸附测定(NAISA),可实现外泌体蛋白的灵敏且快速的多重分析,对早期肝癌诊断和其他癌症类型的鉴定具有广阔的前景。该研究发表于Theranostics杂志上。
外泌体是几乎所有类型的哺乳动物细胞分泌的磷脂膜包裹的纳米级囊泡(直径为30-150nm),携带来自其亲代细胞的遗传和蛋白质信息来介导细胞间的通讯,参与各种病理生理过程,例如炎症、组织再生和癌症转移。最近,外泌体被公认为是癌症液体活检的有前途的生物标志物,特定的外泌体蛋白的水平与疾病状况密切相关,因此可以用作癌症的早期诊断和监测其对治疗反应的指标。因此,外泌体蛋白信息的捕获可以为癌症诊断提供新的机会。
然而,由于外泌体的体积小和化学复杂性,对外泌体蛋白质的快速分析在技术上仍然具有挑战性。由于特异性高,免疫测定法通常用于分析外泌体蛋白。其中,免疫金和蛋白质印迹法代表了鉴定特定蛋白质的金标准方法,但无法对蛋白质进行定量。酶联免疫吸附测定(ELISA)是用于蛋白质测量的经典定量方法。然而,目前ELISA方法通常需要一组检测抗体以用于外泌体蛋白的多重分析,价格较为昂贵。此外,ELISA检测程序需要5-6个孵育和洗涤步骤,从而限制了快速分析的用途。尽管一些先进的检测方法用于了外泌体蛋白分析,但这些检测方法往往依赖于专门的仪器和复杂的程序。因此,非常需要开发一种简单而可靠的方法来快速分析多种外泌体蛋白。
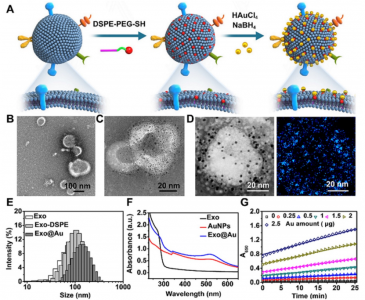
图:金纳米粒子修饰的外泌体(Exo @ Au)的制备示意图和Exo @ Au的表征数据。Exo @ Au上的蛋白质可以通过96孔板中的特异性抗体被选择性捕获。固定化的Exo @ Au通过与3,3',5,5'-四甲基联苯胺(TMB)和H2O2反应,表现出过氧化物酶样活性,可以进行比色测定。
在这项研究里,研究人员描述了一个能够对多种外泌体蛋白进行灵敏、快速分析的纳米酶辅助免疫吸附测定(NAISA)系统。该NAISA系统是将2nm金纳米颗粒(AuNP)安装到外泌体磷脂膜上(如示意图所示),这些纳米颗粒起着过氧化酶样纳米酶的作用,具有很高的催化效率。将过氧化物酶样纳米酶安装在外泌体的磷脂膜上,从而避免了标记后检测抗体的需要。该方法在可在商业化的微孔板上进行,微孔板的表面已固定有针对靶标外泌体蛋白标记物的特异性捕获抗体。用目标蛋白修饰、AuNP修饰的外泌体(称为Exo @ Au)被特异性捕获并催化比色反应。因此,最终得到的信号强度与目标外泌体蛋白的水平成正比。外泌体蛋白可在不到3小时的时间内通过灵敏的纳米酶催化比色测定法测定,无需多步孵育和洗涤操作。
NAISA平台能够从肿瘤细胞系和临床样品中分析多种外泌体蛋白。结果显示,外泌体蛋白(例如CD63、CEA、GPC-3、PD-L1和HER2)的表达水平能够对不同的肿瘤细胞系进行分类。此外,蛋白质谱已被用于高精度区分健康的供体、乙型肝炎患者和肝细胞癌(HCC)患者来源的外泌体。
NAISA技术优于用于外泌体蛋白质分析的常规免疫测定法,原因包括:(1)不需要使用检测抗体;(2)大大简化了检测程序;(3)在区分不同水平的外泌体蛋白方面具有很高的敏感性。NAISA可以在多种细胞系和临床样品中快速分析多种外泌体蛋白,这表明它对于发现癌症生物标记物和早期癌症诊断具有巨大潜力。
数据分析之SPSS统计思维实战专题(8.22-23 网络精讲班)
商务合作、投稿 请联系外泌体君(微信号:exosomer)