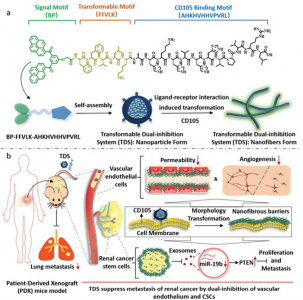
肿瘤脉管系统和肿瘤干细胞加速了肾癌转移,双重抑制血管内皮和肿瘤干细胞是抑制肿瘤转移的策略但难度很大。近日,来自哈尔滨医科大学附属第四医院泌尿外科徐万海、国家纳米科学中心王浩等课题组的研究团队合作提出了一种基于自组装肽的可转化双重抑制系统(Transformable Dual-Inhibition System, TDS),实现对血管内皮细胞和肿瘤干细胞的双重抑制作用,协同抑制肾癌的进展和转移。该研究发表于Small杂志上。
将近90%的癌症患者死于癌症转移。肿瘤脉管系统和肿瘤干细胞(CSC)是加速肿瘤转移的两个主要途径。转移性肾癌高度血管化,并且CSC的大量存在导致患者的临床预后较差。肿瘤脉管系统向肿瘤提供更多的营养以促进其生长。肿瘤新血管结构不成熟,内皮细胞之间连接松动,增加了血管通透性并促进了肿瘤转移。CSC能够无限的自我更新,具有多向分化和低粘附力的能力促进了肿瘤发生和转移。因此,需要双重抑制肿瘤血管内皮生长和CSCs生长的策略,阻止肾癌转移的发展。
CD105是肿瘤新血管内皮细胞和CSC的特异生物标志物,并且是同时抑制两种类型细胞的潜在靶标。研究团队此前的工作已经证明了配体-受体相互作用诱导的自组装肽的结构转变,在生物系统中构建功能纳米纤维,实现了多种生物应用。在这项研究中,研究团队提出了一种基于自组装肽的可转化双重抑制系统(TDS)。模块化分子设计包括三个模块:1)疏水性双芘(BP)基序,具有荧光信号的聚集诱导发射(AIE)效应并诱导纳米颗粒的形成; 2)衍生自β-淀粉状蛋白的自组装肽基序(FFVLK),用于纤维结构的形成和转化; 3)识别肽基序(AHKHVHHVPVRL)用作CD105的配体并诱导TDS转化。首先,TDS通过靶向过度表达的CD105同时特异性识别内皮细胞和CSC。随后,由于基于配体-受体的CD105的相互作用,引发了形态转变,在细胞膜上原位构建了纳米纤维屏障,有助于:1)降低内皮通透性和血管生成; 2)抑制CSCs在肾癌中的干性和转移。对于血管内皮,TDS将血管通透性降低至67.0%±4.7%,并将血管生成降低至62.0%±4.0%,从而阻止了肾癌的转移。对于人源的CSC,TDS通过减少内源性miR-19b及其通过CSC衍生的外泌体的运输来抑制干细胞,从而增加PTEN表达并因此抑制CSC介导的转移。在源自患者的异种移植小鼠模型中,TDS显著抑制肿瘤发生和血管生成。与对照组相比,TDS还能使肺部转移性结节减少5.0倍。因此,TDS为抑制癌症转移开辟了一条有希望的途径。