癌症来源的细胞外囊泡(EVs)被认为具有用作治疗和疾病生物标记物的潜力。EVs已显示出在大多数癌症进展中起作用。包括小型EVs(sEVs)在内的癌症EVs包含独特的生物分子货物,由蛋白质、核酸和脂质组成。通过鉴定这种特定货物,已经有研究鉴定并开发了癌症生物标志物,为癌症诊断和预后开辟了新颖而有趣的机会。但是我们仍然对控制癌细胞中EV生物发生的特定于癌症的途径缺乏全面的了解。填补这一知识空白将迅速改善癌症EVs的生物标志物,因为这也将使这些EVs的促癌和抗癌作用得以区分。更加有前途的发现是发现治疗可靶向的、肿瘤特异性的EV途径和成分,这将产生新型的癌症治疗方法。

近日,Nature Reviews Cancer杂志(影响因子53.03)上发表了一篇题为“The evolving translational potentialof small extracellular vesicles in cancer”的综述,重点介绍了癌症sEV领域在生物标志物发现和验证,以及基于sEV的治疗方面所取得的进展,强调了我们正在面临的挑战,并指出了我们的知识差距,这些差距目前阻碍了我们充分发挥sEV用于癌症诊断和治疗的潜力。
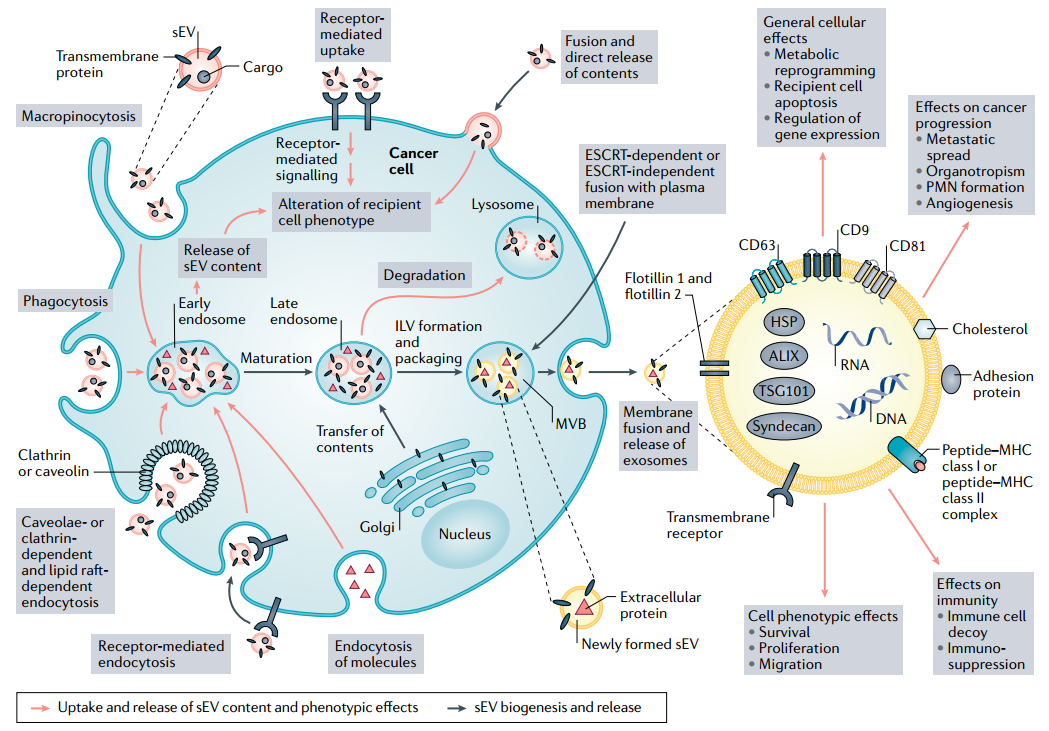
小细胞外囊泡摄取、生物发生、成分和生物学效应。有多种sEVs用于结合受体和/或被受体细胞内化的生物学机制。癌症衍生的sEVs可通过受体介导的内吞作用吸收。sEV四跨膜蛋白(CD9、CD63和CD81)和其他sEV分子引发sEV结合受体细胞。癌症衍生的sEV上发现的某些配体可以激活受体,例如PDL1、FASL和TRAIL,诱导受体细胞内的信号传导。通过小窝依赖性或网格蛋白依赖性和脂质筏依赖性内吞作用的sEV内化似乎与sEV配体无关。富含视蛋白的sEV的吞噬作用主要与巨噬细胞和其他骨髓细胞谱系有关,并且可能导致sEV的细胞内破坏。通过例如EGFR结合激活巨胞饮作用(重要的癌症机制)的配体使得sEV和细胞外物质的非特异性sEV摄取成为可能。然后,sEVs释放到胞质空间,并可能根据其内含物改变细胞的表型。内吞作用导致早期内体的形成和随后晚期内体的成熟。腔内囊泡(ILV)是通过内体限制膜的向内出芽产生的,并形成多囊泡体(MVB)。该过程通过负责sEV生物发生的多种蛋白质进行协调,包括ALIX、TSG101和含L结构域的蛋白质。晚期的内体或MVB与溶酶体融合以降解sEV成分并释放到细胞质中,或与质膜融合释放新形成的sEV,这由多个Rab GTPases协调。这些生物机制导致sEV的蛋白质、核酸和脂质组分不同。典型的表面蛋白,包括四跨膜蛋白、粘附分子(EPCAM、ephrin、整联蛋白和乳粘附素)、MHC I类或II类分子和蛋白聚糖,可用于实验性分离sEV。其中一些蛋白质(ALIX、syndecan和TSG101)也表征了sEV的生物起源。与它们的起源细胞相比,sEV富含各种脂质,包括胆固醇、鞘脂和糖鞘脂。sEV的组分可以介导影响多种细胞和组织功能的细胞间通讯。
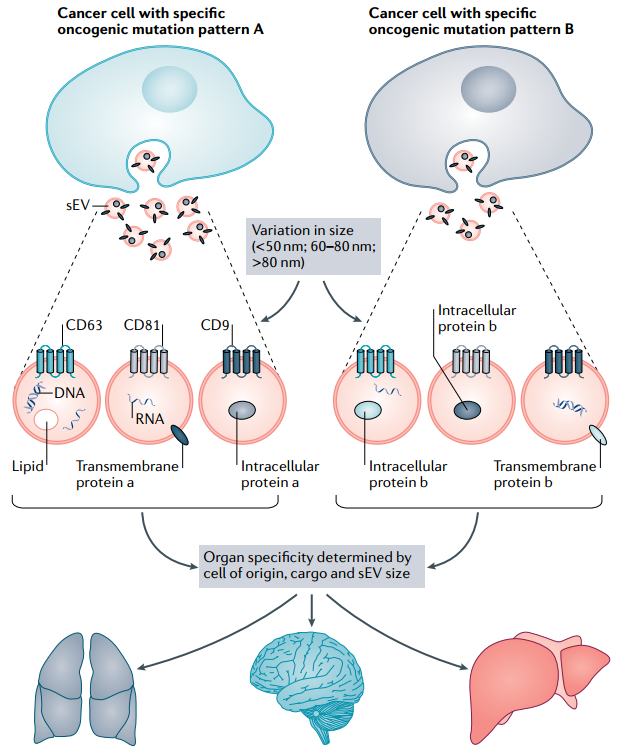
癌症sEV异质性是多方面的。sEV货物与起源细胞相关,致癌突变以及亚群大小的异质性,共同影响sEVs的功能和器官倾向性。具有不同致癌突变模式的癌细胞,产生不同的sEVs。sEV的丰度受致癌突变以及细胞外环境条件(例如,pH、氧气水平、炎症和癌症治疗方法)的影响。此外,分泌的sEV包含基于其生物发生的分子成分(例如,四跨膜蛋白CD9、CD63和CD81)以及部分由致癌突变引起的蛋白质、RNA、DNA和脂质成分。此外,除了四跨膜蛋白标记物的异质性和各种分子成分外,sEVs还具有不同的大小(例如,直径小于50 nm、60-80 nm和大于80 nm的颗粒)。sEVs的大小和货物组成异质性,共同决定了sEVs的器官特异性分布。要充分了解sEV亚群,可能需要了解sEV中这种复杂性的组合。
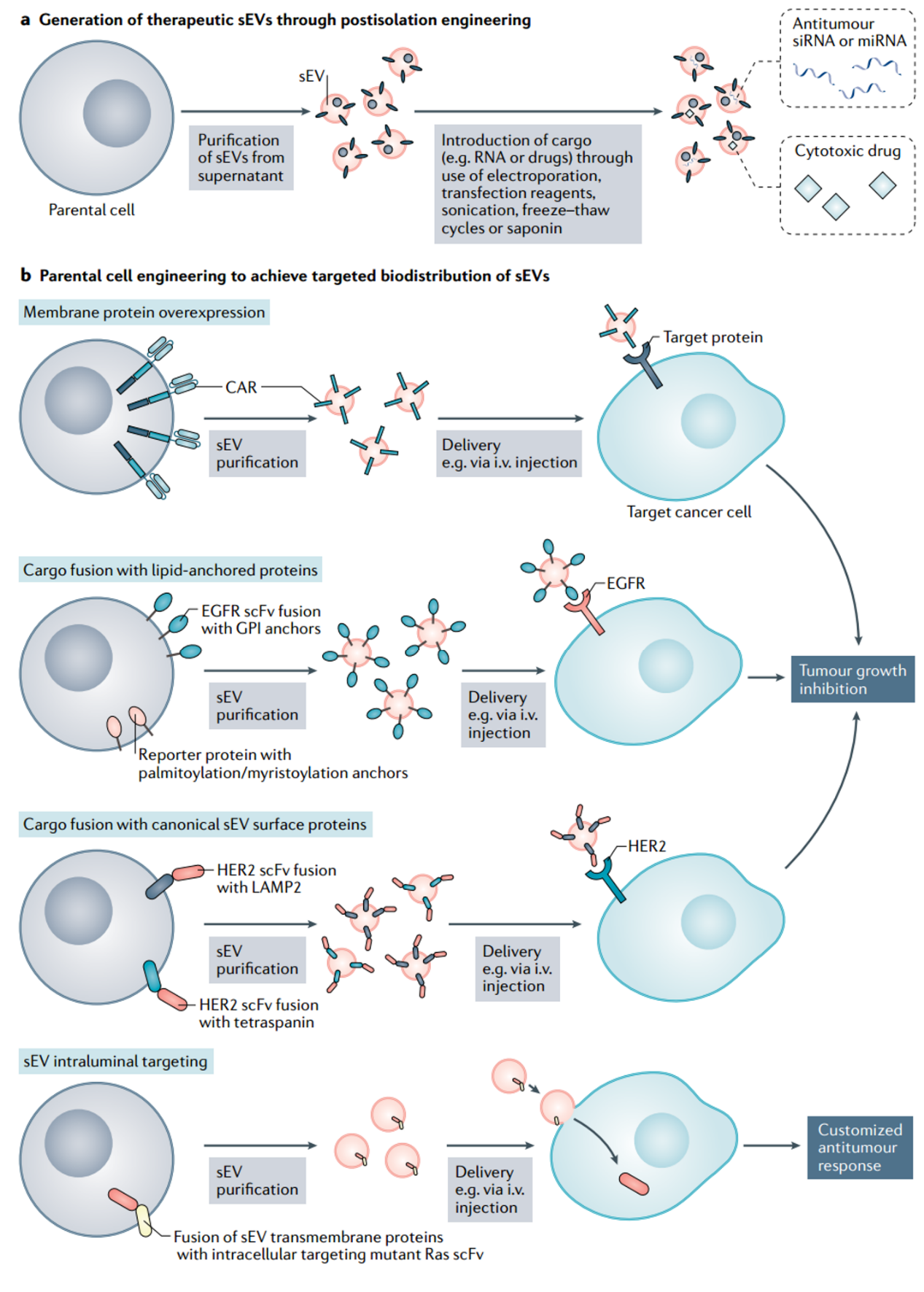
新的基于sEV的疗法的评估和开发。由于固有的长期循环、生物相容性、膜蛋白的有效表达以及治疗相关的生物分子货物的封装,sEV治疗剂显示出巨大潜力。 a. 使用sEV作为抗肿瘤小RNA和化疗药物的载体的兴趣日益浓厚。已经开发了多种纯化后的装载方法,包括使用转染试剂、超声处理、冻融循环、皂苷和电穿孔。载有细胞毒性货物或抗肿瘤miRNA或siRNA的纯化sEV具有抗癌作用。但是,sEV的靶向生物分布是其治疗潜力的关键。b. 通过表达融合脂质锚定蛋白或与sEV常规膜蛋白融合来工程化亲代细胞,可以指导sEV的特异性生物分布,从而导致对正常细胞的毒性作用降低,并提高对癌细胞的治疗功效。可以对sEV的腔内组分进行工程改造以增加递送的sEV的治疗功效。sEV装载的生物机制可通过将蛋白货物与蛋白标签融合以用于sEV包装或四跨蛋白的胞质结构域与诱导结合/释放支架融合以将可溶性蛋白、RNA或抗体传递至细胞。重要的是,纯化后的装载和亲代细胞工程可一起使用,从而既利用了特定的生物分布又提高了抗肿瘤功效。




