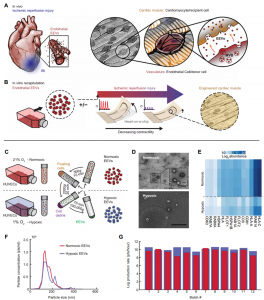
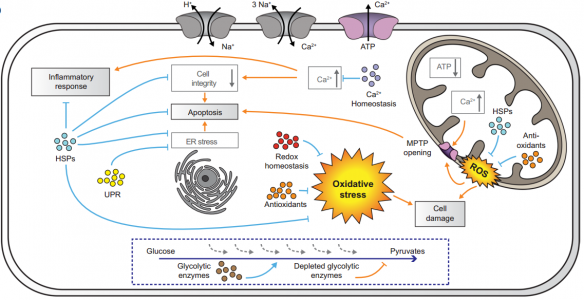
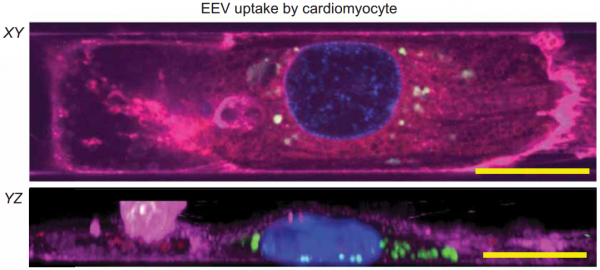
近日,来自哈佛大学的Kevin Kit Parker教授研究组在Science Translational Medicine杂志(影响因子16.304)上发表封面文章,分析了在常氧和低氧条件下内皮细胞释放的细胞外囊泡(EV)中所含的蛋白质,并研究了对心脏组织的体外心脏保护作用。作者使用由心肌细胞组成的人类心脏芯片,表明内皮细胞衍生的囊泡在缺血再灌注损伤期间支持代谢功能、组织收缩和生存能力。这项研究有助于阐明囊泡对人体组织的心脏保护作用。每年,全球有数百万人患有心肌梗死(MI)。最有效的治疗干预措施要求及时、完全恢复流向患处的动脉血流。但是,该过程可能进一步导致心肌细胞死亡,并导致最终的心肌梗死和心力衰竭。这些事件称为缺血再灌注损伤(IRI),最终升级为缺血性心脏病的发展。因此,需要其他的心脏保护策略。对IRI的细胞反应涉及多种病理生理机制,例如钙和质子超负荷、氧化应激、内质网(ER)应激、线粒体功能障碍、凋亡途径激活和心肌冬眠。这套复杂的过程阻碍了有效疗法的发展。另外,MI患者经常患有其他合并症,这会影响治疗效果。因此,由于疾病的复杂性,建议最佳的心脏保护可能需要协同的多靶点治疗。此外,对IRI反应的物种依赖性使得很难将临床前研究成果转化为临床方案,这迫切需要开发人类特异性的临床前研究方法。近年来已经研究了几种基于药物、机械和细胞的疗法。缺血后处理,包括短暂反复的缺血再灌注,已被证明具有保护作用,而组织血运重建方法可以挽救存活的心肌,但不能恢复凋亡组织。而且,靶向单独的分子或信号传导途径的药理学干预已显示出不令人满意的结果。例如,钙通道阻滞剂、抗氧化剂和抗炎药已被证明在减少梗塞面积和改善临床指标方面无效。同样,针对线粒体和一氧化氮信号调节的药物在最近的临床试验中也失败了。细胞疗法通常是安全的,但其疗效仍有争议。几项临床试验发现,将骨髓干细胞移植用于治疗患者的MI几乎没有益处。然而,最近的数据表明,各种来源的干细胞分泌的多种因子在心血管疾病中可能具有良好的治疗效果。具体来说,现在认为源自干细胞的细胞外囊泡(EV),尤其是外泌体,是与干细胞相关的有益作用的关键来源。这些EV已显示出可同时触发由特定miRNA成分介导的血管生成和抗凋亡过程。最近有研究表明,幼稚的非干细胞外泌体减轻了IRI后的心肌细胞死亡。已经表明这是通过激活依赖于膜受体的细胞外信号调节激酶1/2(ERK1/2)途径发生的。鉴于这些证据,目前尚不清楚这些EV是否通过与启动细胞内信号级联反应的膜受体结合或通过跨组织和器官直接递送RNA和蛋白质来发挥其旁分泌作用。灌注的组织中丰富的血管内皮细胞是低氧应激的“第一反应者”:它们直接与实质细胞接触,因此高度参与旁分泌信号传导至包括高血管化心脏在内的身体组织。与其他细胞类型相似,内皮细胞分泌EV(例如外泌体),以蛋白和RNA货物的形式将信息传递至受体细胞(例如,心肌细胞)。该研究假设内皮细胞衍生的EV(EEV)含有能够对心肌产生直接保护作用的货物。为了评估EEV的蛋白质含量是否可以起到介导此类作用的作用,该研究绘制了血管EEV的蛋白质组学图。发现了1800多种蛋白质的多样性,其中与IRI的细胞保护相关的蛋白质非常丰富,其中包括与缺血预处理相关的几种蛋白质。使用人组织心脏芯片(hHOC)IRI分析测试了这些EEV对人组织产生的类似预处理的心脏保护作用。在hHOC模型中,将人类心肌细胞(hCM)组装成一层心室样肌肉,并在缺血期间和之后使用嵌入式传感器连续监测组织的收缩功能。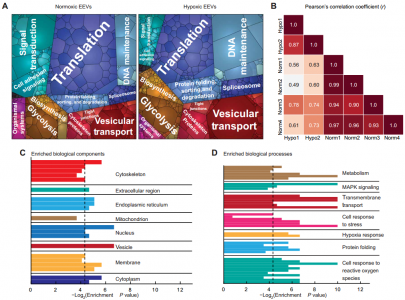 内皮EV的表征研究发现,来自常氧和低氧内皮细胞培养物的EEV增加了常氧心肌细胞的呼吸能力,并抑制了心肌细胞死亡和与IRI相关的收缩功能丧失。蛋白质组学分析表明,EEV处理导致心肌细胞的蛋白质结构从IR损伤变为未损伤。此外,观察到EEV介导的心脏保护作用是剂量依赖性的、需要内化的。该研究表面EEV可以通过向受损的心肌细胞补充支持多种代谢和挽救途径的蛋白质来部分保护人薄层状心脏组织(hlCT)免受IRI损伤,从而为以前未使用的治疗方法铺平了道路。同时,该研究证明了使用hHOC系统在体外对IRI进行建模,并使用实时数据评估治疗效果及其对IRI的动态影响的策略。MoranYadid et al. Endothelial extracellular vesicles contain protective proteins andrescue ischemia-reperfusion injury in a human heart-on-chip. ScienceTranslational Medicine 14Oct 2020: Vol. 12, Issue 565, eaax8005
内皮EV的表征研究发现,来自常氧和低氧内皮细胞培养物的EEV增加了常氧心肌细胞的呼吸能力,并抑制了心肌细胞死亡和与IRI相关的收缩功能丧失。蛋白质组学分析表明,EEV处理导致心肌细胞的蛋白质结构从IR损伤变为未损伤。此外,观察到EEV介导的心脏保护作用是剂量依赖性的、需要内化的。该研究表面EEV可以通过向受损的心肌细胞补充支持多种代谢和挽救途径的蛋白质来部分保护人薄层状心脏组织(hlCT)免受IRI损伤,从而为以前未使用的治疗方法铺平了道路。同时,该研究证明了使用hHOC系统在体外对IRI进行建模,并使用实时数据评估治疗效果及其对IRI的动态影响的策略。MoranYadid et al. Endothelial extracellular vesicles contain protective proteins andrescue ischemia-reperfusion injury in a human heart-on-chip. ScienceTranslational Medicine 14Oct 2020: Vol. 12, Issue 565, eaax8005外泌体资讯网 Science子刊封面:内皮细胞外囊泡中含有保护性蛋白,可挽救人心脏芯片的缺血再灌注损伤

 内皮EV的表征
内皮EV的表征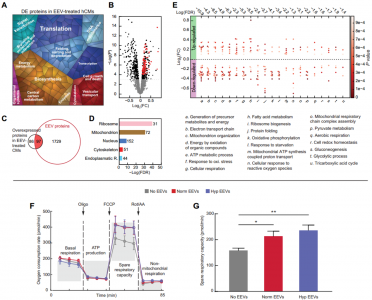



 内皮EV的表征
内皮EV的表征

