血栓形成导致血小板活化和随后的降解;因此,需要从造血干/祖细胞(HSPC)补充血小板来维持循环血小板的生理水平。血小板衍生的微粒(PMP)是从活化的血小板释放的含蛋白质和RNA的囊泡。
近日,军事医学科学院裴雪涛教授、谢小燕教授在Nature Communications杂志上发表了题为“Platelet-derived microparticles enhance megakaryocytedifferentiation and platelet generation via miR-1915-3p”文章,报道了血小板衍生的微粒(PMP)携带的物质以正反馈方式影响HSPC血小板的产生。

微粒(microparticles, MPs)是100-1000 nm细胞衍生的膜结合小颗粒。MPs可以被所有有核细胞以及红细胞和血小板分泌。已经提出,MP通过传递其包含的蛋白质、DNA和RNAs而充当细胞之间消息传递的重要手段。最近,有报道说巨噬细胞的MP诱导幼稚单核细胞分化为巨噬细胞,巨核细胞MP(MK-MPs)促进造血干/祖细胞(HSPC)分化为成熟的巨核细胞(HSK)。因此,该研究假设来自血小板(例如成熟血细胞)的MP(PMP)在引导干细胞向血小板亲本细胞乃至血小板分化发挥积极作用。与MK-MPs不同,PMP是由活化的血小板产生的,携带了血小板特异性的表面标记,并使它们成为病理条件下循环的主要MP。作为巨核细胞生成的最终产物,血栓形成过程中血小板的活化和消耗导致大量PMPs的释放。然而,关于PMP在调节血小板生成中所起的作用知之甚少。
通常,血小板生成受TPO调节。肝细胞是TPO的主要来源。在肝病等表现出肝TPO生成不足的晚期肝病等肝病中,也已报道了病理性血小板破坏,包括血小板生存时间缩短和低度弥散性血管内凝血。在这些疾病中也已报道了由于MPs形成增加和/或清除率降低导致循环PMPs水平升高。在上述某些疾病中,骨髓MK浓度升高或正常,这表明TPO缺乏不能简单地抑制巨核发生。相反,循环中的PMP数量增加可能是造成这一现象的原因。PMP可以包装细胞因子、趋化因子和RNA,将这些生物活性效应子转移至有核受体,并充当信息载体来调节靶细胞的功能。PMP与内皮细胞、肿瘤细胞和免疫细胞之间的相互作用已有许多研究,并且PMP对造血干细胞(HSC)在体内增殖、存活和移植的影响也已有报道。因此,提出了PMP在巨核细胞生成中的作用。
研究假设:PMP通过正反馈机制诱导巨核细胞生成。活化的血小板释放MPs,其中一些可被HSPC内化,并驱动细胞走向巨核细胞命运。结果,可以产生更多的MK和血小板来代替因激活而丢失的血小板。
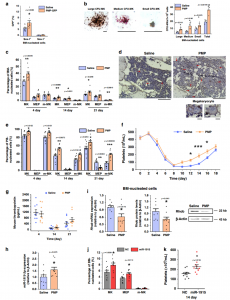
研究显示,在小鼠急性肝损伤期间,随着循环PMP的增加,骨髓中巨核细胞的密度增加,但没有血小板生成素(TPO)上调。在体外,PMP被HSPC内化并带动它们走向巨核细胞命运。从机制上讲,miR-1915-3p是PMP高度富含的miRNA,被转运到靶细胞并抑制Rho GTPase家族B的表达水平,从而诱导巨核细胞生成。此外,将PMP直接注射到受辐照的小鼠中可增加巨核细胞和血小板的数量,而不会影响TPO水平。数据表明PMP在促进巨核细胞分化和血小板产生中具有作用。
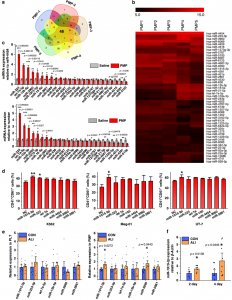
PMP的miRNAs分析
总之,该研究证明了PMPs可以促进MK分化和血小板生成并揭示其潜在机制。探索了PMPs的特性及其介导MK分化的能力。miRNA是PMP的丰富内容物之一。详尽的miRNA分析显示,富含miRNA miR-1915-3p的PMP可以转运至靶细胞并抑制RHOB表达,从而诱导巨核细胞分化。PMP的体内和体外研究表明,潜在的反馈回路参与了血小板数量的调节,这与典型的血小板调节理论相辅相成,在传统的血小板调节理论中,生理和病理性血小板生成受TPO调节。PMP在MK反馈调节中的重要作用可能会扩展我们对谱系稳态的了解。
注射外源PMP可刺激MK分化和血小板生成