细胞通过释放含有高度特异性蛋白质和RNA货物的外泌体来对炎症疾病状态做出反应,但是炎症如何改变货物特异性和外泌体的分泌尚不清楚。堪萨斯大学医学中心的研究人员在J Cell Biol杂志(影响因子8.811)上发表文章,报道显示病毒感染或LPS/ATP暴露引起的外泌体分泌增加是由炎性体激活和随后的运输适配器蛋白RILP的caspase-1依赖性剪切引起的。RILP的这种切割形式促进了多囊泡体向细胞周围的运动,并诱导选择性的外泌体miRNA装载。该研究鉴定出存在于miRNA中的常见短序列基序,这些基序在RILP切割后被选择性地加载到外泌体中。该基序与RNA结合蛋白FMR1结合,并通过与ESCRT(运输所需的内体分拣复合体)途径的相互作用,将miRNA导入外泌体。这些结果表明,炎性体介导的RILP剪切以及miRNA与FMR1之间的序列特异性相互作用,在细胞炎症反应期间,在外泌体负载和增强分泌中起着重要作用。
Nat Rev Mol CellBiol杂志(影响因子55.47)对该研究进行了Research Highlights推荐。
有大量证据表明,许多病因的炎症引起外泌体分泌急剧增加。此外,炎症刺激后产生的外泌体并不是简单地反映出随机的细胞组分样本,而是蛋白质和miRNA的组成均与正常产生的外泌体有所不同。尽管有几个研究小组将这种外泌体的增加与炎性体的激活相关联,但炎症导致外泌体分泌增加的细胞机制还有待确定。
炎性小体是一种多蛋白平台,可在细胞感染或应激后激活,最终参与免疫防御。一旦激活,活性炎症小体的caspase-1成分就会进行许多过程,包括裂解细胞蛋白。然后可以通过几种细胞囊泡运输途径,包括外泌体生物发生的部位多囊泡体(MVB),从细胞分泌这些蛋白质/货物。
外泌体是通过管腔内的MVB出芽形成的,转运所需的内体分选复合物(ESCRT)途径是管腔内囊泡(ILV)和MVB的形成描述最充分的机制。ESCRT复合物是一种多蛋白复合物,不仅可以控制ILV侵入MVB,而且可以识别、捕获泛素化蛋白货物并将其分选到ILV中。ESCRT-0,-I和-II复合物识别并隔离内体膜上的泛素化膜蛋白,ESCRT-III负责向内出芽和膜分裂。直到MVB与质膜融合,外泌体才释放到细胞外环境中。含外泌体的MVB向质膜的运输,随后的对接和融合的确切机制尚不清楚;然而,溶酶体运输途径中的几种Rab GTPases,特别是Rab27a和Rab27b,与外泌体的装载和分泌有关。Rab GTPases募集特定的效应蛋白最终推动了货物的收集,细胞器的运动性以及囊泡停靠在目标膜上。因此,Rab GTPases及其效应物经常被入侵的病原体和宿主所使用,以此作为促进病原体生命周期和/或改变免疫应答的手段。
该研究团队先前观察到丙型肝炎病毒(HCV)感染导致Rab7转运衔接蛋白RILP的剪切。RILP是将运输的GTP酶Rab7与动力蛋白复合物连接的复合物的一部分。RILP的切割产生结合Rab7但不能与动力蛋白复合物连接的截短的蛋白质。这改变了囊泡运输并促进了驱动蛋白介导的向细胞表面的运动。RILP剪切最早在感染后3天发生,引起含病毒体的细胞内囊泡重新分布,并提高了病毒体分泌的效率。进一步研究表明,caspase-1是裂解RILP的酶,因此将炎性体激活与有效的病毒分泌联系在一起。剪切形式的RILP(cRILP)的形成还诱导了其他细胞内细胞器的重新分布,包括MVB。
外泌体包含多种生物分子,包括miRNA。细胞应激(例如病毒感染和炎症)会导致这些外泌体分子的丰度发生独特变化,这表明将货物装载到外泌体中并不是一个被动过程,并且必然存在一种特异性机制来分选那些miRNA。实际上,已经描述了影响外泌体miRNA分选的几种途径和分子,包括脂质/神经酰胺,直接miRNA修饰,以及与MVB生物发生途径的组成部分相互作用。
RNA结合蛋白(RBPs)是转录后加工和RNA分子调控的关键参与者,它们与MVB组分的直接相互作用增加了RBPs可能与外泌体miRNA分选相关的可能性。因此,存在于MVB上的RBP可能在确定选择哪些RNA包含在外泌体和分泌到细胞外方面发挥作用。但是,通过MVB识别RBP-RNA复合物的机制以及如何将RNAs分选在外泌体中的机制仍然不清楚。
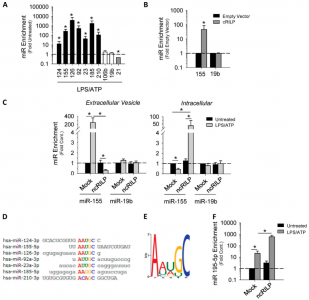
由于细胞炎症通常以外泌体分泌增加为特征,并且由于caspase-1激活是许多细胞中炎性体激活的结果,因此该研究团队试图确定是否导致caspase-1介导的炎症变化导致了外泌体分泌增强 RILP剪切。研究发现剪切的RILP的形成不仅影响外泌体分泌,而且还通过与外泌体形成机制相互作用,重新定位MVB以及通过与FMR1的相互作用改变外泌体负载的miRNA选择性而影响选择性miRNA的负载。
RILP剪切状态调节外泌体货物的装载和特异性
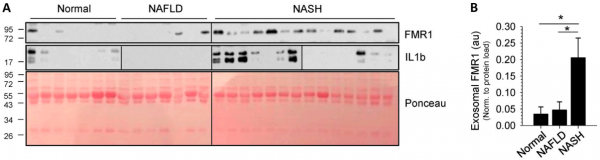
炎症性肝病患者分离出的外泌体富含FMR1
参考文献:
WozniakAL, Adams A, King KE, Dunn W, Christenson LK, Hung WT, Weinman SA. The RNAbinding protein FMR1 controls selective exosomal miRNA cargo loading duringinflammation. J Cell Biol. 2020 Oct 5;219(10):e201912074.doi: 10.1083/jcb.201912074. PMID: 32970791.
WillsonJ. RILP gets cleaved and exosomes leave. Nat Rev Mol Cell Biol.2020 Nov;21(11):658-659. doi: 10.1038/s41580-020-00299-6. PMID: 32989292.