肿瘤来源的细胞外囊泡能够传递活性生物分子,如蛋白质,核酸等进入受体细胞,在肿瘤微环境中促进血管形成、调控免疫细胞功能、重构肿瘤微环境、促进肿瘤细胞的生长和迁移。虽然细胞外囊泡普遍存在糖基化修饰的现象,但相对于细胞外囊泡中的核酸和蛋白分子,糖基化修饰对细胞外囊泡的包装、分拣、内吞等功能的研究尚不够深入。
近日,西北大学生命科学学院关锋教授团队在平分型GlcNAc修饰抑制乳腺癌来源细胞外囊泡的促迁移作用的研究中取得了新进展,研究结果以研究长文(Article)形式发表在Journal of Extracellular Vesicles,题名 “Bisecting GlcNAc modification diminishes the pro-metastatic functions of small extracellular vesicles from breast cancer cells ”。
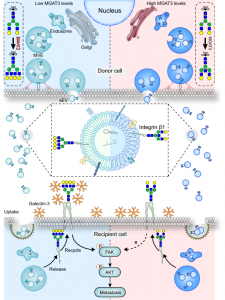
图. 整合蛋白β1上平分型GlcNAc修饰抑制胞外囊泡功能的示意图
平分型GlcNAc修饰是在N-乙酰氨基葡糖转移酶(MGAT3)的催化下,将GlcNAc以β-1,4糖苷键连接在五糖核心中的甘露糖上所形成,平分型GlcNAc修饰能够抑制糖链的延伸,改变蛋白质的糖基化修饰水平,从而影响蛋白质的结构和功能。该研究发现,乳腺癌发展发展过程中平分型GlcNAc修饰水平显著下降,且乳腺癌细胞来源细胞外囊泡表达低水平的平分型GlcNAc修饰,而低平分型GlcNAc修饰的细胞外囊泡显著促进受体细胞的迁移能力;反之,平分型GlcNAc修饰水平的升高会抑制细胞外囊泡对受体细胞的促迁移作用。通过糖蛋白质组手段,发现乳腺癌细胞来源胞外囊泡对受体细胞迁移能力的调控,依赖于细胞外囊泡膜表面整合蛋白(Integrin)β1的平分型GlcNAc修饰水平。该研究阐明了细胞外囊泡表面糖基化修饰的重要性,并提示细胞外囊泡膜表面糖基化修饰的改性有望成为癌症治疗的新方向。
Journal of Extracellular Vesicles杂志为细胞外囊泡领域的顶级期刊(中科院一区,IF=14.976)。西北大学生命科学学院博士后谭增琦、博士生曹琳为论文共同第一作者,西北大学关锋教授和李想教授,以及浙江大学医学院代志军教授为共同通讯作者。本研究受到国家自然科学基金、国家重大科技专项、陕西省自然科学基金,陕西高校青年创新团队等项目的支持。