越多的证据表明,外泌体在肿瘤转移前微环境形成中起着重要作用。近日,来自中国航天员科研训练中心李英贤课题组和中国农业大学于舒洋课题组与的研究人员在Theranostics杂志上发表文章,揭示了乳腺癌细胞分泌外泌体miR-21促进破骨细胞生成,重塑肿瘤微环境并促进骨转移。该发现揭示了乳腺癌骨转移的一个新机制,为临床诊断和治疗提供了新的见解。
乳腺癌是女性癌症相关死亡的第二大主要原因,乳腺癌患者在疾病发展过程中经常出现骨转移。溶骨性骨转移发生在80%的晚期乳腺癌患者中,并伴有各种骨骼并发症,例如神经压迫、病理性骨折和高钙血症。乳腺癌患者的传统疗法包括放射疗法、化学疗法和辅助化学疗法,最近批准的几种骨特异性药物也只能缓解骨骼相关的并发症,但由于治疗抗性,死亡率仍较高。乳腺癌的骨转移仍然是乳腺癌患者最普遍的威胁,因此需要进一步研究乳腺癌骨转移的详细机制,并发现用于临床诊断和治疗的新的潜在生物标志物。
在过去的几十年中,越来越多的证据表明,骨转移的乳腺癌细胞显示出特定的固有分子特征。同时,远处器官的原发性肿瘤基质和特定的基质成分也决定了乳腺癌的骨转移,例如肿瘤与脉管系统之间的相互作用,有助于肿瘤转移至骨组织。骨骼是动态组织,是最常见的癌症转移部位之一,通过破骨细胞和成骨细胞来调节其生命周期。除了骨骼环境独特的物理化学特性外,骨髓微环境的细胞结构,包括破骨细、成骨细胞和造血干细胞,在骨骼发育、重塑和修复中起着重要作用,为乳腺癌转移提供了优势。最近的研究表明,乳腺癌细胞分泌大量的分子,例如血管细胞粘附分子等,直接或间接刺激破骨细胞的活性。这些细胞外通讯促进骨降解并塑造转移前的微环境,从而促进乳腺癌的进展。
外泌体是直径为30至200 nm的细胞外膜囊泡,通过在生理和病理条件下在细胞之间转移大量核酸和蛋白质来介导细胞间通讯。最近,越来越多的研究表明,肿瘤来源的外泌体有助于产生合适的微环境,以使转移的肿瘤细胞移入并定植。前列腺癌分泌的外泌体hsa-miR-940和丙酮酸激酶M2通过促进宿主间充质细胞的成骨分化诱导转移前的成骨细胞病变。乳腺癌来源的外泌体可以破坏远处器官的血管内皮屏障,从而增加脑和肺转移的发生率。但是,乳腺癌分泌的外泌体是否通过转移前微环境的形成影响溶骨性骨转移尚不清楚。这些机制的确定可能揭示开发新的乳腺癌治疗靶标的新途径。
最近的证据表明,乳腺来源的miRNA通过外泌体转移在肿瘤的发生和发展中起着关键作用,包括调节乳腺肿瘤的生长和转移和转移部位的微环境。 miR-21是高度保守的miRNA,在许多类型的癌症患者的血清中高表达,包括肝细胞癌、肺癌和乳腺癌。多项研究表明,miR-21参与了肿瘤的发展和破骨细胞的分化。例如,miR-21通过直接结合PDCD4来促进破骨细胞分化过程中NFATc1的上调,后者对c-Fos反式激活具有抑制作用。
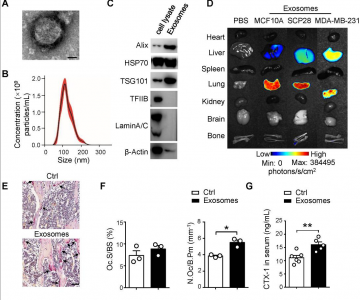
在这项研究中,研究团队发现乳腺癌细胞分泌的外泌体通过促进破骨细胞分化来促进转移前微环境的产生。研究人员在小鼠原位植入SCP28肿瘤细胞,导致破骨细胞活性增加和骨密度降低,有助于形成肿瘤细胞的转移前微环境。SCP28细胞分泌的外泌体是促进破骨细胞分化和激活的关键因素,从而加速了骨病变,从而重建了用于骨转移的微环境。机制上,源自SCP28细胞的外泌体miR-21通过调节PDCD4蛋白水平促进破骨细胞生成。此外,骨转移的乳腺癌患者的血清外泌体中的miR-21水平显著高于其他人群。这些结果表明,乳腺癌细胞衍生的外泌体在促进乳腺癌骨转移中起重要作用,这与外泌体miR-21转移至破骨细胞而形成转移前微环境有关。