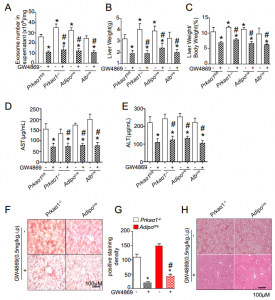
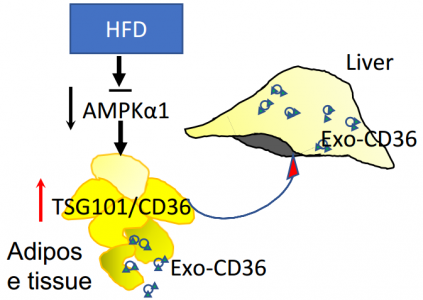
解放军沈阳军区总医院全军心血管病研究所所长韩雅玲院士团队与佐治亚州立大学合作在Diabetes杂志上发表文章,报道了AMPKα1的下调有助于高脂饮食诱导的非酒精性脂肪肝(NAFL)。AMPKα1的下调通过增加外泌体的生物发生和分泌来增强白色脂肪组织(WAT)与肝脏之间的通讯。通过AMPK激活抑制WAT释放外泌体是治疗NAFL发展的新型治疗靶点。外泌体是细胞分泌的纳米大小的生物小泡(30-100 nm),它们含有来自亲本细胞的microRNA、mRNA和蛋白质。当外泌体被受体细胞内化后,它们通过传递其内部生物活性成分发挥调节作用。越来越多的证据表明,外泌体在细胞间通讯中起重要作用,包括免疫应答、肿瘤进展和细胞代谢。理解外泌体生物发生和异质性调节的分子机制是一项重大挑战。脂肪组织(AT)是重要的内分泌器官,具有调节能量代谢的中心作用。肥胖引起的AT损伤和异位沉积是导致胰岛素抵抗、糖尿病和非酒精性脂肪肝(NAFL)的主要病理因素。值得注意的是,AT是外泌体的主要来源。例如,在培养的AT和脂肪细胞中观察到外泌体分泌。此外,肥胖显著增加了体内AT的外泌体分泌。相反,与体重减轻相关的特定刺激(例如饥饿和雷帕霉素)会显著减少外泌体分泌。这些结果强烈表明,AT是循环外泌体的主要来源,而体重动态调节着循环外泌体的水平。由于肥胖与包括NAFL疾病在内的代谢紊乱的发生密切相关,因此必须确定AT衍生的外泌体在NAFL发生中的作用。AMP活化蛋白激酶(AMPK)是细胞内一种普遍存在的能量感应酶,对于维持代谢稳态是至关重要的。AMPK的激活被认为可介导二甲双胍的有益作用,二甲双胍是全球使用最广泛的抗糖尿病药物。有趣的是,肥胖动物和人类中WAT中AMPK活性降低。AMPK活性减弱对外泌体生物发生,货物含量和WAT脱落的影响尚不清楚。该研究报道了WAT中的AMPKα1激活通过消除外泌体的生物发生和分泌减轻了HFD诱导的NAFL。在高脂饮食(HFD)或经二甲双胍或GW4869以及经AMP活化蛋白激酶(AMPKα1)floxed(Prkaα1fl/fl/WT)、Prkaα1-/-、肝组织特异性Prkaα1-/-或AT特异性Prkaα1-/-的小鼠AT中,监测外泌体成分、肝脂肪含量和肝功能。在培养的脂肪细胞和白色脂肪组织(WAT)中,AMPKα1的缺失通过提高肿瘤易感性基因101(TSG101)介导的外泌体生物发生而增加了外泌体释放和外泌体蛋白质。在用棕榈酸处理的脂肪细胞中,TSG101促进了CD36进入外泌体的分选。然后,含有CD36的外泌体被肝细胞内吞以诱导脂质蓄积和炎症。HFD诱导Prkaα1-/-和脂肪组织特异性Prkaα1-/-小鼠比野生型和肝特异性Prkaα1-/-小鼠更严重的脂质蓄积和细胞死亡。二甲双胍激活AMPK减少了野生型和肝脏特异性Prkaα1-/-小鼠的脂肪细胞介导的外泌体释放并减轻了脂肪肝的发展。此外,在Prkaα1-/-和脂肪细胞特异性Prkaα1-/-小鼠中,外泌体抑制剂GW4869的施用阻断了外泌体分泌并减轻了HFD诱导的脂肪肝。得出的结论是,HFD介导的AMPKα1抑制通过增加包含AT CD36的外泌体的数量来促进NAFLD。YanC, Tian X, Li J, Liu D, Ye D, Xie Z, Han Y, Zou MH. A High-Fat DietAttenuates Amp-Activated Protein Kinase α1 in Adipocytes to Induce ExosomeShedding and Nonalcoholic Fatty Liver Development in Vivo. Diabetes.2020 Dec 1:db200146. PMID: 33262120.外泌体资讯网 【Diabetes】韩雅玲院士团队:高脂饮食抑制AMPKα1,诱导外泌体释放和非酒精性脂肪肝的发展