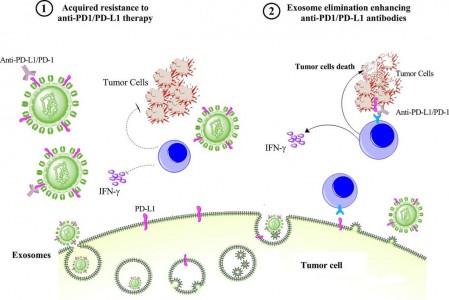
外泌体作为细胞外囊泡的主要组,肿瘤衍生的外泌体富含免疫抑制蛋白,例如PD-L1。尽管阻断PD-1 / PD-L1相互作用的单克隆抗体已在临床上用于癌症治疗,但仍有一些患者对PD-1/ PD-L1治疗反应不良。近日,来自广东省医学科学院广东省人民医院陈盛、殷子课题组的研究人员在Journalfor ImmunoTherapy of Cancer杂志上发表综述,总结了外泌体PD-L1在抗PD-1 / PD-L1治疗的治疗抗性中的作用,去除外泌体PD-L1可以作为增强肿瘤患者PD-1 / PD-L1治疗功效的治疗辅助方式。
免疫检查点是细胞表面调节受体,主要但非唯一地位于T淋巴细胞上。在识别抗原呈递细胞或靶细胞上的同源配体后,这些受体充当T细胞受体(TCR)共信号传递伙伴,传递刺激或抑制信号来调节淋巴细胞的活化。程序性细胞死亡蛋白1(PD-1)是关键的免疫检查点分子,被称为活化T细胞中表达的主要抑制性共受体之一。在正常生理情况下,免疫检查点(例如PD-1)维持自我耐受、预防自身免疫并将T细胞反应控制在所需的生理范围内,以保护组织免于过度的炎症反应。但是,在癌症下,这些调节蛋白可以使肿瘤细胞保护自身免受抗肿瘤T细胞反应的影响,从而导致所谓的肿瘤免疫逃避。
PD-1通过与PD-L1相互作用而起作用,PD-L1是非淋巴组织中高度表达的配体,对细胞毒性T细胞产生的炎性细胞因子(如干扰素IFN-γ)产生反应。通过募集包含SHP1 / 2的Src同源结构域在T细胞中传递共刺激信号,该磷酸酶使下游TCR介导的信号传导元件去磷酸化,从而抑制T细胞增殖、细胞因子的释放以及细胞毒性。因此,PD-1 / PD-L1调节系统由免疫反应诱导,然后通过负反馈回路减弱T细胞反应并减少组织损伤。
外泌体是分泌的细胞外囊泡的主要群体,是具有生物活性的脂双层囊泡,大小约为30-100nm,由不同类型的正常细胞和肿瘤细胞自然产生和释放。这些囊泡在细胞间通讯中起重要作用,并影响细胞外环境和免疫系统反应。外泌体通过内体途径分泌到细胞外空间,并将各种生物活性分子(货物)转运至靶细胞。外泌体货物的组成非常多样化,包括各种免疫抑制和免疫刺激蛋白、趋化因子、细胞因子、细胞受体、脂质以及不同的核酸,例如miRNA和环状RNA。
肿瘤细胞可以通过产生异常的抗肿瘤或肿瘤免疫应答并促进肿瘤细胞的活动而大量产生外泌体,这些外泌体富含促癌的细胞成分,例如PD-L1、mRNA和micro-RNA等免疫抑制蛋白,参与癌症的发展、转移和耐药性。值得注意的是,肿瘤分泌的外泌体表面和外泌体颗粒中均存在的PD-L1。 ESCRT(运输所需的内体分选复合体)参与将生物分子包装到外泌体中,nSMase2(中性鞘磷脂酶2)和Rab蛋白调节外泌体分泌。已确定ESCRT、Rab27a和nSMase2参与外泌体PD-L1的包装和分泌。外泌体可以将PD-L1转运至其他PD-L1表达低或没有PD-L1的细胞,并可能与PD-1结合。
血浆/血清外泌体上表达的PD-L1,与癌症患者(如HNSCC和NSCLC)的疾病进展和临床病理特征相关。值得注意的是,外泌体上表达的主要组织相容性复合物(MHC)分子在外泌体PD-L1介导的肿瘤促进中起着至关重要的作用。实际上,外泌体MHC I与TCR的分子相互作用增强了外泌体PD-L1对T细胞的抑制作用。这些可能是外泌体PD-L1比可溶形式的PD-L1带来更高的免疫抑制作用的原因。
在这篇综述中,研究人员突出并总结了有关外泌体PD-L1在PD-1 / PD-L1疗法中的作用。外泌体PD-L1可通过使肿瘤细胞逃避抗肿瘤免疫,来复制肿瘤细胞表面PD-L1本身的作用。外泌体还可以将PD-L1从起源的肿瘤细胞传递到PD-L1表达低或不表达的其他细胞类型,从而抑制全身性抗肿瘤免疫和记忆。肿瘤患者血浆中外泌体PD-L1的水平与抗PD-1 / PD-L1治疗的反应率呈负相关。有证据表明,在动物模型中去除外泌体PD-L1可以增加抗PD-L1治疗的反应。这些发现均与外泌体PD-L1介导的对抗PD-L1 / PD-1疗法的抗性一致。尽管外泌体PD-L1的治疗耐药性的潜在机制仍是未知的,但该综述提出了一些可能的机制。循环的外泌体PD-L1可以与PD-1 / PD-L1抗体相互作用并限制其治疗效率。而且,高水平的外泌体PD-L1可以与PD-L1 / PD-1抗体竞争。因此,使用抗外泌体治疗的联合治疗可以协同抗PD-1 /PD-L1的治疗效果。但是,由于正常的细胞分泌外泌体对于维持正常的生理至关重要,因此候选药物应选择性抑制肿瘤特异性外泌体,以降低潜在的毒性副作用。如果毒性研究证实缺乏安全性,则从血液中去除分泌的PD-L1 阳性外泌体也可能是一种有效的策略。
参考文献:Yin Z, Yu M, Ma T, Zhang C, Huang S,Karimzadeh MR, Momtazi-Borojeni AA, Chen S. Mechanisms underlying low-clinical responses to PD-1/PD-L1 blocking antibodies in immunotherapy of cancer: a keyrole of exosomal PD-L1. J Immunother Cancer. 2021 Jan;9(1):e001698.